쥐똥나무의 밀원가치 평가: 화밀 특성과 잠재적 꿀 생산량 분석
Abstract
This study assessed the nectar productivity and bee forage potential of Ligustrum obtusifolium by investigating its growth and flowering traits, nectar volume, and the concentration and composition of free sugars and amino acids. To evaluate its contribution to apiculture, the honey production potential was also estimated. An average of 848.7 flowers per square meter was observed in hedge-type stands, with peak anthesis occurring in early June. The second day of flowering showed the highest nectar volume and sugar content, and the nectar composition was classified as sucrose-dominant. A total of 19 amino acids were detected, including functional compounds such as proline, glutamine, and asparagine. The estimated honey yield averaged 46.1 kg per hectare, categorizing the species as a low-grade nectar source. For the sustainable development of the apiculture industry, it is essential to maintain and expand bee forage plants. These results suggest that L. obtusifolium has potential as a supplementary forage plant for honeybees.
Keywords:
Ligustrum obtusifolium, Nectar productivity, Free sugar, Amino acids, Honey yield, Bee forage plant서 론
국내 양봉산업의 규모는 지속적으로 증가하고 있지만, 천연꿀 생산량은 하락하고 있다 (이 등, 2019). 이러한 현상은 국내 최대 밀원수인 아까시나무의 면적 및 개체수 감소, 기후변화에 의한 채밀 여건 악화 (전국 동시개화, 개화량 저조 등) 등 다양한 원인이 복합적으로 작용한 결과이다. 그러나 그중에서도 밀원자원의 부족이 가장 핵심적인 원인으로 지목되고 있다.
밀원식물의 다양성을 확보하여 품질이 우수하고 영양적으로 균형 잡힌 화밀을 충분히 공급하는 것은 단순히 양봉산물 생산량을 높이는 데 그치지 않고, 꿀벌의 강건성 유지에도 중요한 역할을 한다 (Carter et al., 2006; Nepi, 2014). 화밀에 포함된 당과 아미노산은 꿀벌의 선호도를 결정짓는 주요 요인으로, 특히 아미노산 함량과 구성은 꿀벌의 방문 빈도를 결정하는 주요 요인으로 보고되고 있다 (Bell, 2003; Carter et al., 2006; Kessler and Baldwin, 2007; Anraku et al., 2015; Silva et al., 2020). 또한, 화밀의 당은 화분매개곤충의 주요 에너지원이자 꿀의 기초 성분으로, 꿀벌은 자당 함량이 높은 화밀을 선호하는 경향을 보인다 (Baker and Baker, 1983).
따라서 꿀벌의 건강과 양봉산업의 지속가능성을 위해서는 생산성이 높은 밀원식물의 확보가 필요하며, 이를 위해 수종별 개화 특성, 화밀 생산량, 화밀 내 성분 조성 등 전반적인 정보가 구체적으로 마련되어야 한다 (Jachuła et al., 2018; Ayers and Rehan, 2021; Tew et al., 2021). 특히 화밀 내 당과 아미노산의 농도 및 조성은 식물 종에 따라 상이하므로, 개별 식물별로 질적·양적 특성을 정량적으로 파악하는 작업이 선행되어야 한다 (Somme et al., 2016; Jachuła et al., 2019; Strzałkowska-Abramek et al., 2019; Dmitruk et al., 2022).
쥐똥나무 (Ligustrum obtusifolium Siebold & Zucc.)는 우리나라 전역에서 생육 가능한 낙엽활엽관목으로 (Jang et al., 2020), 내한성과 내공해성이 우수하고 자생력과 번식력이 뛰어나 조경수 및 생울타리 등으로 널리 활용되고 있다 (Jeong et al., 2015; Dekebo et al., 2022). 유럽에서는 물푸레나무과 (Oleaceae) 식물이 주요 밀원식물로 간주되며 (Petanidou, 2003; Wright et al., 2018; Mureşan, 2022), 특히 Ligustrum속은 풍부한 개화량과 향기, 화밀 성분 조성 등에서 꿀벌이 선호하는 밀원식물로 평가되고 있다 (Dekebo et al., 2022).
국내에서도 쥐똥나무 (L. obtusifolium)는 ‘양봉산업의 육성 및 지원에 관한 법률’ 시행규칙 제2조에 명시된 주요 밀원식물에 포함되어 있으나(농림축산부, 2020), 개화 및 화밀 특성, 꿀 생산량, 화학적 조성 등에 대한 과학적 연구는 보고된 바 없다. 이에 본 연구에서는 쥐똥나무의 생장 및 개화 특성을 비롯하여, 화밀 분비량, 유리당 및 아미노산 조성을 정량적으로 분석하고, 이를 바탕으로 잠재적 꿀 생산량을 추정함으로써 쥐똥나무의 생태적·산업적 밀원가치를 평가하고자 한다.
재료 및 방법
1. 생장 및 개화량 측정
조사목은 경기도 수원 (37°16ʹ3ʺN, 126°56ʹ49ʺE)에 위치한 국립산림과학원 생명자원연구부 구내에 높이 1.5 m, 폭 1.0 m의 생울타리로 생육 중인 개체들이다. 본 연구의 조사지는 매년 전정을 통해 수형 관리가 이루어지는 곳으로, 다수의 맹아지가 울타리 형태로 자라고 있어 개별 나무의 흉고직경, 수고 등 생장 정보를 측정하기에 적절하지 않았다. 따라서 면적당 꽃 수를 측정하여 개화량을 추정하였다. 꽃 수는 30×30 cm의 사각틀을 이용하여 30반복으로 조사하였으며, 개화지당 꽃 수를 별도로 조사하여 단위 면적당 꽃 수를 산출하였다 (Fig. 1). 개화 시기는 조사구 3곳의 각 방위별 가지 3개씩 선정한 후, 누적 개화율이 5% 이상 개화한 시기를 개화 시작일, 누적 개화율이 30∼70% 유지되는 시기를 개화 최성기, 누적 개화율이 95% 이상이며, 개화한 꽃이 모두 낙화한 시기를 개화 종료일로 판단하여 조사하였다.
2. 화밀 분비량 조사
화밀 수집을 위해 병해충 피해가 없는 가지를 대상으로 이미 개화한 꽃은 제거한 후 화분매개자 차단망을 설치하였다. 조사구의 방위를 고려하여 30개 꽃을 조사하는 것을 기본으로 하였으며, 시점별 8반복으로 평균 화밀 분비량을 산출하였다. 쥐똥나무의 꽃은 개화 2일차까지 유지되다가, 3일차 오전에 낙화되므로 개화 2일차까지의 일자별 누적 화밀 분비량을 조사하였다. 채집한 꽃은 원심분리기 (Microfuge 16, Beckman Coulter, USA)를 이용하여 4,000 rpm으로 4분 동안 화밀을 수집하였다 (Swanson and Shuel, 1950; Armstrong and Paton, 1990). 튜브에 모인 화밀은 50~100 μL microliter syringe (Hamilton Co., Reno, NV, USA)를 이용하여 정량하였으며, 미생물에 의한 당 분해를 방지하기 위해 80% 에탄올 (v/v)을 화밀량의 10배액을 첨가하였다 (Morroni et al., 2018). 0.45 μM pore centrifuge filter를 이용하여 화분 등 이물질을 정제하였으며, -20℃에서 보관하였다.
3. 유리당 및 아미노산 함량 분석
유리당 분석은 HPLC (Dionex ultimate 3000, Dionex, USA)를 이용하여 분석하였다. 이동상으로는 3차 증류수를 사용하였고, 유속은 0.5 mL/min, 온도는 80℃로 설정하였다. 유리당의 표준품으로는 sucrose, glucose, fructose (Sigma Aldrich, USA)를 사용하였으며, Aminex87P column (Bio-rad, USA)을 사용하여 Ri-101 detector (Shodex, Japan)로 검출하고, 적분계에 의한 외부표준법을 이용하여 계산하였다 (Linear regression equation, R2>0.999). 각 유형별로 식별된 당 구성을 이용해 S/H ratio (sucrose/glucose+fructose)와 G/F ratio (glucose/fructose)를 산정하였다 (Nicolson and Thornburg, 2007).
아미노산은 수집된 화밀을 O-phthalaldehyd (OPA)-Fluorenylmethyl chloroformate (FMOC) 유도체화하여 분석하였다. Borate buffer, OPA/Mercaptopropionic acid (MPA), FMOC 시약에 시료를 단계적으로 혼합한 다음, HPLC (1200 series, Agilent Technologies, USA)를 이용하여 분석하였다. 이동상은 10 mM Na2HPO4, 10 mM Na2B4O7·10H2O가 포함된 A용액 (pH 8.2)과 water : acetonitrile : methanol를 10 : 45 : 45 비율로 혼합된 B용액에 대하여 A용액 : B용액으로 초기 100 : 0 (v/v, %)에서 26∼28분에 55 : 45, 28∼30.5분에 0 : 100, 30.5분부터는 100 : 0의 조건으로 설정하였다. 유속 1.5 mL/min에서 1 mL를 주입하였으며 컬럼 (Inno column C18, Innopiatech, Korea) 온도는 40℃로 유지하였다. 자외선 검출기는 338 nm로 설정하였으며, 형광 검출기를 이용하여 OPA 유도체는 방출 파장 450 nm, 여기 파장 340 nm, FMOC 유도체는 방출 파장 305 nm, 여기 파장 266 nm에서 분석하였다.
4. 잠재적 꿀 생산량 추정
꽃 하나당 화밀량과 단위 용량당 당 및 아미노산 함량의 곱으로 꽃 하나당 당과 아미노산 함량을 산출하였으며, Petanidou (2003)가 제시한 honey potential과 생장 특성에 따른 개화량을 산출하여 본당 및 ha당 잠재적 꿀 생산량을 다음의 계산식을 통해 추정하였다 (Kim et al., 2021a, 2021b, 2022).
- Vn: 꽃 하나당 화밀 분비량 (μL/flower)
- Cs: 단위 용량당 유리당·아미노산 (μg/μL)
- Fs: 꽃 하나당 유리당·아미노산 (mg/flower)
- Ys: 단위 면적당 꿀 생산량 (g/m2
- Nf: 단위 면적당 꽃 수(개/m2
- Nh: 1 ha당 생육가능 본 수(본/ha)
- Yh: ha당 총 꿀 생산량 (kg/ha)
- 1Honey potential (1.15) = sugar content : honey = 85 : 100
5. 통계 분석
통계 소프트웨어 패키지 JMP 18.1.1 software (SAS Institute, Cary, NC, USA)를 이용하여 정규성 검정과 등분산 검정을 실시하였다. 시점별 화밀량과 유리당 함량은 T-검정을 이용하여 분석하였으며, 유의수준 (p-value)은 0.05로 설정하였다.
결 과
1. 개화 특성
쥐똥나무는 평균적으로 화서당 꽃 수는 54.9개였으며, 30×30 cm (900 cm2) 내 화서수는 평균 15.5개였다. 이에 900 cm2의 꽃 수는 848.7개로 추정되었으며, 이를 바탕으로 1.5 m×1.0 m×100 m의 생울타리 형태의 쥐똥나무는 약 2,826,060개의 꽃이 개화될 수 있는 것으로 나타났다. 경기도 수원에서 쥐똥나무의 개화는 5월 29일에 시작하여 6월 13일에 종료되었으며, 개화 최성기는 6월 3일부터 8일까지 지속되었고, 전체 개화 기간은 16일이었다 (Table 1).
2. 화밀 분비량
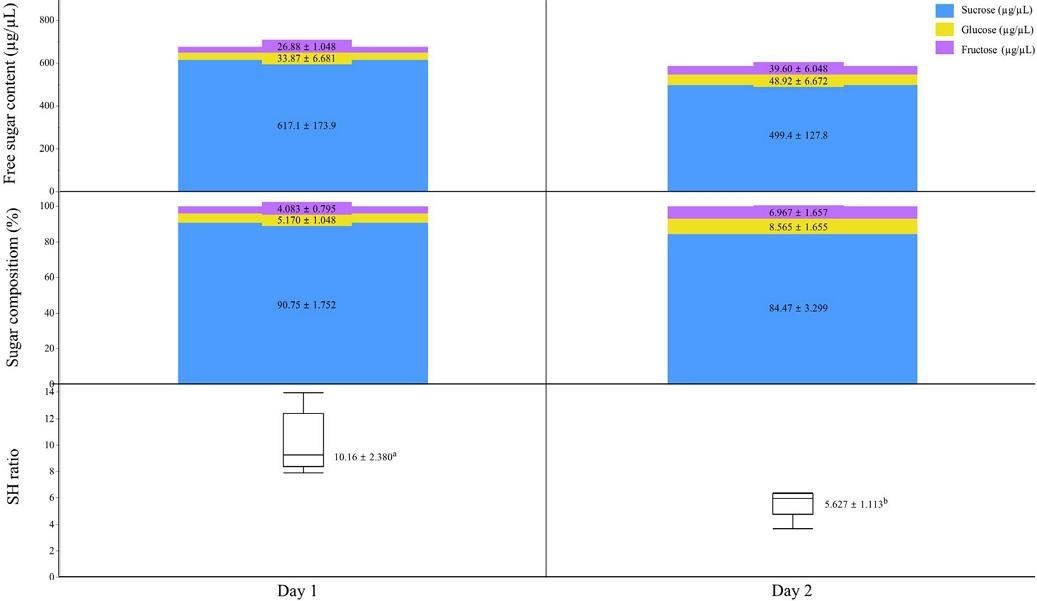
개화 1일차와 2일차의 꽃 하나당 누적 화밀량은 각각 0.38 μL와 0.73 μL로, 2일차에서 유의하게 더 많은 화밀이 분비되었다 (p<0.001). 반면, 단위 용량당 유리당 함량은 1일차 677.9 μg/μL, 2일차 587.9 μg/μL로 유의한 차이는 없었다 (p=0.401). 그러나 이를 기반으로 산출된 꽃 하나당 유리당 함량은 1일차 0.24 mg, 2일차 0.43 mg으로 개화 2일차에서 유의하게 높았다 (p<0.01) (Table 2).
3. 유리당 조성
쥐똥나무의 화밀 내 유리당 조성을 분석한 결과, 주요 당 성분은 자당 (sucrose), 포도당 (glucose), 과당 (fructose)으로 확인되었다. 개화 1일차의 경우, 자당의 평균 농도는 617.1 μg/μL로 전체 유리당 함량의 약 91%를 차지하였으며, 포도당 (33.87 μg/μL)과 과당 (26.88 μg/μL)은 각각 5.2%와 4.1%의 낮은 비율로 나타났다. 개화 2일차에는 자당의 농도가 평균 499.4 μg/μL로 감소하였고, 포도당과 과당의 농도는 각각 48.92 μg/μL와 39.60 μg/μL로 증가하였지만, 자당이 전체 유리당의 약 85%를 구성하여 sucrose/hexose (S/H ratio) 비율이 1.0 이상으로 sucrose-dominant 등급으로 구분되었다 (Fig. 2).
4. 아미노산 조성
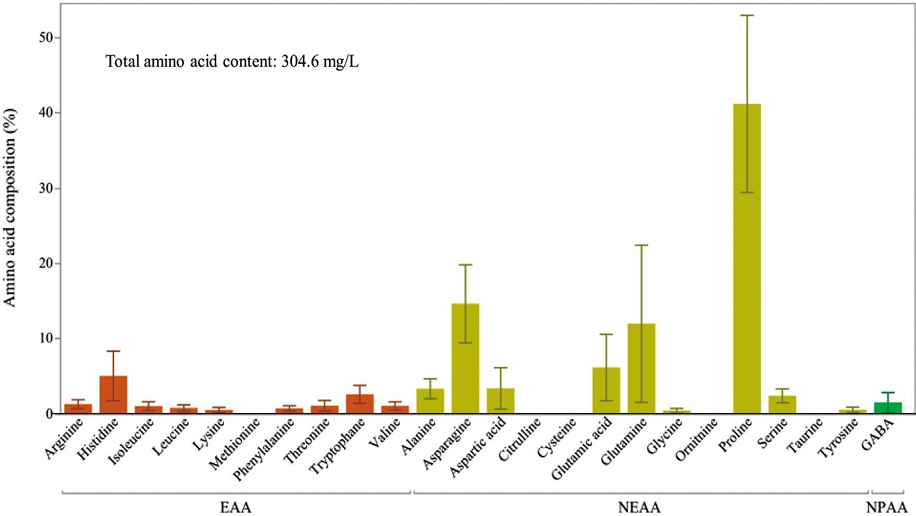
화밀 내 아미노산 조성을 분석한 결과, 쥐똥나무의 화밀에서는 총 19종의 아미노산이 검출되었다. 단위 용량당 총 아미노산 함량은 304.6 mg/L였으며, 비필수 아미노산 (non-essential amino acids, NEAA)의 상대적 비율 (85.71%)이 필수 아미노산 (essential amino acids, EAA)보다 현저히 높았다. 비필수 아미노산 중 프롤린 (Proline)은 평균 41.19%로 전체 아미노산 중 가장 높은 함량을 보였으며, 아스파라긴 (Asparagine, 14.63%), 글루타민 (Glutamine, 11.99%), 글루탐산 (Glutamic acid, 6.177%) 순으로 검출되었다. 필수 아미노산 중에서는 히스티딘 (Histidine)이 5.055%로 가장 높았으며, 트립토판 (Tryptophan, 2.608%), 아르기닌 (Arginine, 1.310%), 트레오닌 (Threonine, 1.104%) 순으로 높은 값을 보였다. GABA는 1.510%로 검출되었다 (Fig. 3).
5. 잠재적 꿀 생산량 추정
쥐똥나무의 화밀 특성과 생장 특성을 바탕으로 꿀 생산량을 추정한 결과, 150 m2당 기준으로 평균 1,397 g, 최소 747 g, 최대 2,249 g으로 나타났다. ha당 평균 꿀 생산량은 46.1 kg으로, 추정 범위는 24.6~74.2 kg이었다.
고 찰
본 연구에서는 쥐똥나무가 짧은 개화기간 동안 높은 밀도로 개화하며, 이 시기 동안의 화밀 분비량 또한 통계적으로 유의미하게 증가함을 확인하였다 (Tables 1 and 2). 이러한 결과는 쥐똥나무가 밀원자원으로서 활용 가능성이 있음을 정량적 지표를 통해 입증한 것이다.
특히, 화밀의 자당 비율은 평균 85% 이상으로 나타나, 자당 우세형 (sucrose-dominant) 화밀 특성을 갖는 것으로 확인되었다 (Fig. 2). 이러한 화밀 구성은 꿀벌의 에너지 효율성과 선호도를 충족시키는 이상적인 조건으로 평가되며 (Baker and Baker, 1983; Nicolson and Thornburg, 2007), 실제로 꿀벌은 자당/헥소스 비율 (S/H ratio)이 높은 화밀에 대해 더 높은 선호도를 보이는 것으로 알려져 있다 (Cnaani et al., 2006). 이러한 선호 경향은 꿀벌의 방문 빈도 증가로 이어지며, 결과적으로 채밀 효율성을 향상시키는 데 기여할 수 있다 (Nicolson and Thornburg, 2007).
아미노산 분석 결과, 총 19종의 아미노산이 검출되었고, 이 중 비필수 아미노산이 대부분을 차지하였다 (Fig. 3). 특히 Proline, Glutamine, Asparagine이 높은 농도로 존재하였으며, 이들 아미노산은 꿀벌의 대사 에너지 공급, 신경계 기능 유지, 스트레스 완화 등 다양한 생리적 기능에 관여하는 성분으로 보고되어 있다 (Carter et al., 2006; Anraku et al., 2015; Wright et al., 2018). 이 중 Proline은 꿀벌의 체류 시간 증가 및 채집 기억력 향상과 밀접한 관련이 있어, 꿀벌의 지속적인 방문을 유도하는 데 효과적인 인자로 간주된다 (Hendriksma et al., 2014). 또한, 비단백질 아미노산인 GABA도 1.51%의 비율로 검출되었으며 (Fig. 3), 이는 꿀벌의 학습능력 향상 및 체류 시간 연장에 긍정적인 영향을 미칠 수 있는 가능성을 시사한다 (Bell, 2003; Silva et al., 2020).
쥐똥나무의 ha당 평균 꿀 생산량은 46.1 kg으로 추정되었으며, 이는 Petanidou (2003)의 밀원 생산성 분류 기준에 따라 ‘저생산성’ 범주 (<200 kg/ha)에 속한다. 그러나 이 기준은 상대적으로 고생산성을 보이는 제한된 수종에 초점을 두고 있어, 다양한 밀원수종의 기능성과 실용성을 반영하기에는 한계가 있다 (Baude et al., 2016; Vaudo et al., 2020). 실제로, 최근 여러 연구에서는 꿀벌의 영양 균형 유지와 장기적인 생존을 위해서는 단일 고생산성 밀원수종에 의존하기보다는, 개화 시기가 분산된 다양한 저·중생산성 수종이 복합적으로 구성된 자원 환경이 보다 효과적이라는 점을 강조하고 있다 (Ghazoul, 2006; Lazaro et al., 2009; Na et al., 2024).
이러한 맥락에서 쥐똥나무는 ha당 꿀 생산량은 중간 이하 수준이나, 단기간의 집중적인 개화, 자당 우세형 화밀, 기능성 아미노산 조성, 높은 식재 용이성 및 도시 조경 활용 가능성 등의 특성을 기반으로, 주요 밀원수인 아까시나무 개화 전·후 시기에 꿀벌에게 안정적인 먹이자원과 채밀 환경을 제공할 수 있는 ‘양봉산업 활성화 전략 수종’이자 ‘보완적 밀원자원 (supplementary forage plant)’으로서 생태적·산업적 가치가 매우 높은 수종으로 판단된다.
적 요
본 연구는 쥐똥나무 (Ligustrum obtusifolium)의 밀원가치를 평가하기 위하여 생장 및 개화 특성, 화밀 분비량, 유리당 및 아미노산 함량 및 구성을 조사하였으며, 양봉산업 기여도를 산정하기 위해 잠재적 꿀 생산량을 추정하였다. 생울타리로 조성된 조사목에서 단위면적당 개화량은 848.7개였으며, 개화 최성기는 6월 초였다. 개화 2일차에 화밀량과 유리당 함량이 가장 높았으며, 유리당 조성은 자당 우세형 (sucrose-dominant)으로 나타났다. 총 19종의 아미노산이 검출되었으며, 프롤린, 글루타민, 아스파라긴 등의 기능성 아미노산이 포함되었다. 꿀 생산량은 ha당 평균 46.1 kg으로 ‘낮은 등급’의 밀원자원으로 평가되었다. 양봉산업의 지속가능한 발전을 위해서는 밀원식물의 유지와 확대가 필수적으로 동반되어야 하며, 본 연구의 결과는 쥐똥나무가 보조 밀원수종으로 활용 가능함을 시사한다.
Acknowledgments
본 연구는 국립산림과학원 산림과학연구사업 (FG0403-2023-01-2025)의 지원으로 수행되었습니다.
References
- 이정민, 김용렬, 김창호, 우성휘. 2019. 양봉산업 위기와 시사점. 한국농촌경제연구원 제178호. pp. 1-27.
- 농림축산식품부. 2020. 양봉산업의 현황과 정책 방향. 농식품정책 브리핑 제85호.
-
Armstrong, D. P. and D. C. Paton. 1990. Methods for measuring amounts of energy available from banksia inflorescences. Austral Ecol. 15: 291-297.
[https://doi.org/10.1111/j.1442-9993.1990.tb01033.x]

- Anraku, M., A. Kondo, M. Yagasaki, S. Nagano, M. Oyama and Y. Hirayama. 2015. Antioxidant effects of amino acids on protein carbonyl formation in metal-catalyzed oxidation system. J. Clin. Biochem. Nutr. 56: 8-13.
-
Ayers, A. C. and S. M. Rehan. 2021. Supporting bees in cities: how bees are influenced by local and landscape features. Insects 12: 128.
[https://doi.org/10.3390/insects12020128]

- Baker, H. G. and I. Baker. 1983. Floral nectar sugar constituents in relation to pollinator type. pp. 117-141. in Handbook of experimental pollination biology, by Jones, C. E. and R. J. Little (eds.). Van Nostrand Reinhold. New York. USA.
-
Baude, M., W. E. Kunin, N. D. Boatman, S. Conyers, N. Davies, M. A. K. Gillespie, R. D. Morton, S. M. Smart and J. Memmott. 2016. Historical nectar assessment reveals the fall and rise of floral resources in Britain. Nature 530: 85-88.
[https://doi.org/10.1038/nature16532]

- Bell, S. A. 2003. GABAergic neurotransmission in the insect nervous system. Microsc. Res. Tech. 62(4): 196-209.
-
Carter, C., S. Shafir, L. Yehonatan, R. G. Palmer and R. Thornburg. 2006. A novel role for proline in plant floral nectars. Naturwissenschaften 93(2): 72-79.
[https://doi.org/10.1007/s00114-005-0062-1]

-
Cnaani, J., J. D. Thomson and D. R. Papaj. 2006. Flower choice and learning in foraging bumblebees: effects of variation in nectar volume and concentration. Ethology 112: 278-285.
[https://doi.org/10.1111/j.1439-0310.2006.01174.x]

-
Dekebo, A., M. Kim, M. Son and C. Jung. 2022. Comparative analysis of volatile organic compounds from flowers attractive to honey bees and bumblebees. J. Ecol. Environ. 46: 07.
[https://doi.org/10.5141/jee.21.001]

-
Dmitruk, M., M. Strzałkowska-Abramek, M. Bożek and B. Denisow. 2022. Plants enhancing urban pollinators: Nectar rather than pollen attracts pollinators of Cotoneaster species. Urban For. Urban Green. 74: 127651.
[https://doi.org/10.1016/j.ufug.2022.127651]

-
Ghazoul, J. 2006. Floral diversity and the facilitation of pollination. J. Ecol. 94(2): 295-304.
[https://doi.org/10.1111/j.1365-2745.2006.01098.x]

-
Hendriksma, H. P., K. L. Oxman and S. Shafir. 2014. Amino acid and carbohydrate tradeoffs by honey bee nectar foragers and their implications for plant-pollinator interactions. J. Insect Physiol. 69: 56-64.
[https://doi.org/10.1016/j.jinsphys.2014.05.025]

-
Jachuła, J., A. Konarska and B. Denisow. 2018. Micromorphological and histochemical attributes of flowers and floral reward in Linaria vulgaris (Plantaginaceae). Protoplasma 255: 1763-7116.
[https://doi.org/10.1007/s00709-018-1269-2]

-
Jachuła, J., B. Denisow and M. Strzałkowska-Abramek. 2019. Floral reward and insect visitors in six ornamental Lonicera species - Plants suitable for urban bee-friendly gardens. Urban For. Urban Green. 44: 126390.
[https://doi.org/10.1016/j.ufug.2019.126390]

-
Jang, J. E., S. H. Oh, M. J. Choi, J. H. Lee, G. Y. Chung and H. J. Choi. 2020. A taxonomic revision of Ligustrum (Oleaceae) in Korea. J. Asia-Pac. Biodivers. 13: 406-429.
[https://doi.org/10.1016/j.japb.2020.03.016]

- Jeong, H. J., D. S. Kim and Y. H. Ko. 2015. Study on the ecological characteristics and utilization of Ligustrum obtusifolium. Korean J. Environ. Hort. 33: 423-430.
-
Kessler, D. and I. T. Baldwin. 2007. Making sense of nectar scents: the effects of nectar secondary metabolites on floral visitors. Plant J. 49: 840-854.
[https://doi.org/10.1111/j.1365-313X.2006.02995.x]

-
Kim, Y. K., H. W. Yoo, H. Y. Kwon and S. J. Na. 2021a. Honeybee foraging activity and evaluation of honey value from Chaenomeles speciosa (sweet) Nakai. J. Apic. 36: 161-168.
[https://doi.org/10.17519/apiculture.2021.09.36.3.161]

-
Kim, Y. K., H. W. Yoo, M. S. Park, H. Y. Kwon, M. J. Kim and S. J. Na. 2021b. Evaluation of honey production of Camellia japonica L. J. Apic. 36: 149-159.
[https://doi.org/10.17519/apiculture.2021.09.36.3.149]

-
Kim, Y. K., S. J. Na, H. Y. Kwon and W. G. Park. 2022. Evaluation of Honey Production of Ligustrum japonicum and Viburnum odoratissimum var. awabuki in the Southern Part of Korea. J. Apic. 37: 35-44.
[https://doi.org/10.17519/apiculture.2022.04.37.1.35]

- Lazaro, A., R. Lundgren and Ø. Totland. 2009. Co-occurrence, habitat use and phenology of pollinators in the highlatitude alpine: how does plant diversity influence pollinator diversity? Oecologia 160(3): 543-554.
-
Morroni, G., J. M. Alvarez-Suarez, A. Brenciani, S. Simoni, S. Fioriti, A. Pugnaloni, F. Giampieri, L. Mazzoni, M. Gasparrini, E. Marini, M. Mingoia, M. Battino and E. Giovanetti. 2018. Comparison of the antimicrobial activities of four honeys from three countries (New Zealand, Cuba, and Kenya). Front. Microbiol. 9: 1378.
[https://doi.org/10.3389/fmicb.2018.01378]

-
Mureşan, C. I., M. Cornea-Cipcigan, R. Suharoschi, S. Erler and R. Mărgăoan. 2022. Honey botanical origin and honeyspecific protein pattern: Characterization of some European honeys. LWT-Food Sci. Technol. 154: 112883.
[https://doi.org/10.1016/j.lwt.2021.112883]

-
Na, S. J., Y. K. Kim and J. M. Park. 2024. Nectar characteristics and honey production potential of five rapeseed cultivars and two wildflower species in South Korea. Plants 13: 419.
[https://doi.org/10.3390/plants13030419]

-
Nepi, M. 2014. Beyond nectar sweetness: the hidden ecological role of non-protein amino acids in nectar. J. Ecol. 102(1): 108-115.
[https://doi.org/10.1111/1365-2745.12170]

-
Nicolson, S. W. and R. W. Thornburg. 2007. Nectar chemistry. In: Nicolson, S.W., M. Nepi and E. Pacini (Eds.), Nectaries Nectar. Springer, Dordrecht, pp. 215-264.
[https://doi.org/10.1007/978-1-4020-5937-7_5]

-
Petanidou, T. 2003. Nectar production and yield in Mediterranean plants. Pl. Syst. Evol. 238(1-4): 87-100.
[https://doi.org/10.1007/s00606-002-0278-x]

- Silva, C. B. da, D. S. R. de Sousa and E. M. Costa 2020. The role of GABA in the neurobiology of insects. Neotrop. Entomol. 49: 1-11.
- Silva, C. I., D. P. Silva, J. D. Nascimento and A. J. S. Pacheco-Filho 2020. Floral resource availability and nectar sugar concentration of Brazilian bee plants. Apidologie 51(4): 495-508.
-
Somme, L., L. Moquet, M. Quinet, M. Vanderplanck, D. Michez, G. Lognay and A.-L. Jacquemart. 2016. Food in a row: urban trees offer valuable floral resources to pollinating insects. Urban Ecosyst. 19: 1149-1161.
[https://doi.org/10.1007/s11252-016-0555-z]

-
Strzałkowska-Abramek, M. 2019. Nectar and pollen production in ornamental cultivars of Prunus serrulate (Rosaceae). Folia Hortic. 31: 205-212.
[https://doi.org/10.2478/fhort-2019-0015]

-
Swanson, C. A. and R. W. Shuel. 1950. The centrifuge method for measuring nectar yield. Plant Physiol. 25: 513-520.
[https://doi.org/10.1104/pp.25.3.513]

-
Tew, N. E., J. Memmott, I. P. Vaughan, S. Bird, G. N. Stone, S. G. Potts and K. C. R. Baldock. 2021. Quantifying nectar production by flowering plants in urban and rural landscapes. J. Ecol. 109: 1747-1757.
[https://doi.org/10.1111/1365-2745.13598]

- Vaudo, A. D., L. M. Farrell, H. M. Patch, C. M. Grozinger and J. F. Tooke. 2020. Bee nutrition and floral resource restoration. Curr. Opin. Insect Sci. 38: 77-87.
-
Wright, G. A., S. W. Nicolson and S. Shafir. 2018. Nutritional physiology and ecology of honey bees. Annu. Rev. Entomol. 63: 327-344.
[https://doi.org/10.1146/annurev-ento-020117-043423]