
봉독이 편측성 요관 폐색으로 유도된 마우스 신섬유화에 미치는 영향
Abstract
Progressive renal fibrosis is the final common pathway for kidney diseases leading to chronic renal failure. Epithelial-mesenchymal transition (EMT) is known to be the critical mechanisms of the development and aggravation of chronic kidney injury. In this study, we examined the therapeutic effects of bee venom (BV) on the progression of renal fibrosis using the unilateral ureteral obstruction (UUO) model. UUO group increased the expression of fibrosis-related genes including FSP-1, PAI-1 and Vimentin, whereas these expressions were significantly decreased by BV treatment. The number of cells positive for ILK was increased in UUO mice, but decreased by BV treatment. In addition, β-catenin, and Snail1 expression was increased in UUO mice, while this effect was significantly decreased with BV treatment. The UUO operation significantly induced expression of Vimentin, and inhibited expression of E-cadherin compared to normal kidney. However, BV treatment markedly decreases Vimentin expression, and increases E-cadherin expression. In summary, these findings suggest that BV attenuate renal fibrosis and reduce EMT responses by suppression of pro-fibrotic genes, and EMT-related genes.
Keywords:
Bee venom, Renal fibrosis, UUO, EMT서 론
만성신질환은 사구체신염, 당뇨, 고혈압 등과 같은 다양한 원인으로 발생하며, 요독 물질이 체내에 축적되어 여러 장기에 이상을 초래하는 질환이다(박, 2004). 신질환의 진행에서 중요한 조직학적 변화는 신세뇨관의 위축 및 섬유모세포와 세포외기질의 축적, 간질의 섬유화, 사구체의 경화 등이 있다(윤 등, 2002). 이러한 변화는 여러 원인의 신손상에 나타나는 공통적인 증상이며, 그 중 신섬유화는 염증성 병변의 마지막 단계로써 만성신부전에 이르는 최종의 경로로 알려져 있다(Fern et al., 1998; 권등, 2007).
신섬유화는 상피세포의 중간엽세포화(epithelialmesenchymal transition, EMT) 과정을 통하여 증식된 섬유아세포로 인하여 초래된다(김, 2012). EMT는 상피세포가 세포 극성 및 부착성이 상실되고, 이로 인해 세포 표현형이 변화하여 이동성이 있는 중간엽세포의 특징을 나타나게 되는 현상이다(Blechschmidt et al., 2008; Nakaya et al., 2008; Saito et al., 2004). 이러한EMT는 정상배아 발생과정 및 암의 전이 과정에서 많은 연구가 이루어졌으나, 최근 만성 염증성질환으로 인한 섬유화 과정에도 중요한 역할을 하는 것으로 보고되고있다(Michael et al., 2004; Kalluri and Neilson, 2003).
본 연구에서는 신섬유화를 유도하기 위하여 편측성 요관폐색(unilaeral ureteral obstruction, UUO) 모델을 이용하였다. UUO는 신조직 손상 과정을 연구할 수 있는 모델의 하나로 진행성 신장질환의 병태생리학적 연구에 유용하며, 여러 연구에서 UUO 모델을 이용하여 신섬유화의 기전 및 예방, 진행 억제에 관한 연구를 수행하였다(구, 2001, Klahr S. and Morrissey, 1998; Diamond et al., 1998). UUO 모델은 요관 결찰에 의한 신조직 내의 기계적 환경 변화가 국소적 염증반응을 활성화시켜 신조직 손상에 관여한다는 보고가 있다(Klahr, 1991; Harris, 1993; Diamond, 1995). 이처럼 UUO 모델 등 신섬유화에 대한 많은 연구들이 이루어졌으나 신섬유화 및 그에 따른 신질환을 치료할 수 있는 뚜렷한 치료제가 없는 실정이다.
봉독은 꿀벌(Apis mellifera)의 독낭에 들어 있는 약 40여 가지의 유효성분으로 구성된 순수 천연물질로 다양한 생리활성을 가지며, 예로부터 자연 치료법으로 많이 사용되어 왔다(Lee et al., 2003). 봉독의 효능에 관한 연구는 염증성 질환이나 통증성 질환 연구에 국한되어 있었으나, 최근 연구를 통하여 봉독은 만성간질환의 특징인 간세포 손상을 억제할 뿐만 아니라, 만성간경화 동물모델에서도 간경화를 억제하여 만성경화성 질환에서 봉독의 효능이 입증된 바 있다(김 등, 2009; 박 등, 2007; Kim et al., 1997). 따라서, 본 연구에서는 UUO로 유도된 신섬유화 동물모델에 봉독을 투여하여 섬유화와 EMT관련 인자들을 확인함으로써 봉독의 신기능 개선을 통한 치료약물로서의 가능성을 탐색하고자 한다.
재료 및 방법
시험물질
본 실험에 사용한 봉독은 국내에서 사육중인 서양종 꿀벌(Apis mellifera)로부터 봉독 채집장치((주)청진바이오텍, 안산, 대한민국)를 이용하여 봉독을 채취하였고, 불순물을 제거하여 순수 정제봉독(purified bee venom)을 취하였다. 정제봉독은 -20°C에서 보관하고, 투여 직전 멸균 수에 용해시킨 후 필요한 농도로 희석하여 사용하였다.
실험동물
본 연구에서는 UUO를 이용하여 신섬유화 과정에서 봉독의 섬유화 억제효과를 확인하였다. 실험동물은 8주령 수컷 Balb/c 마우스(20~25g)를 샘타코 BIO KOREA(오산, 대한민국)로부터 제공받아 7일간 순화 및 사육을 거쳐 건강한 동물만을 실험에 이용하였다. 실험용 마우스는 난괴법에 따라 총 6마리씩 정상군(Normal control, NC), 정상 마우스에 봉독을 0.01mg/kg로 복강투여 한 군(BV), UUO군, UUO 수술 후 봉독을 0.01mg/kg로 복강투여 한 군(UUO/BV)으로 나누었다. 군별로 케이지에 분리시키고 사료와 물을 자유롭게 섭취하도록 하였다. UUO 수술은 마취된 마우스를 앙와위로 한 뒤 복부의 정중선에 절개를 한 후, 복부 근육과 복막을 절개하여 좌측 신장 및 요관을 노출시켰다. 요관의 운동성으로 요관임을 확인한 후 좌측 요관을 상하로 5-0 실크 봉합사를 이용하여 각각 2번 결찰하였다. 봉독은 UUO 수술 직 후 0.01mg/kg의 농도로 신장 주위로 도포하였으며, 수술 3일 후 복강 주사하였다. 수술7일후희생시켜각군의신장을적출하였다.
RNA분리 및 역전사 중합효소 연쇄반응(Reverse-transcription polymerase chain reaction, RT-PCR) 분석
분리한 신장조직은 적출 즉시 신우를 중심으로 장축으로 잘라 그 반을 액체질소에 동결한 후 total RNA 추출 시까지 -70°C에 보관 하였다. 신장 조직에 TRIzol reagent (Gibco, NY, USA)를 첨가하여 homogenizer로 조직을 분쇄하고, 조직을 얼음에 꽂아 20분간 상온에 방치하였다. Chloroform을 넣어 15초간 섞어주고 12,000 rpm에서 20분간 원심분리하였다. 상층액에 동량의 Isopropyl alcohol을 넣어 -70°C에서 1시간 동안RNA를 침전시킨 후, 75% 에탄올로 세척하여 RNA를 분리하였다. 분리된 RNA는 -70°C에 보관하였다. 추출한 RNA 1μg을 주형으로 사용하여 42°C에서 60분, 95°C에서 10분간 반응시켜 cDNA를 합성하였다. 합성한 cDNA를 주형으로 하여 plasminogen activator inhibitor (PAI) -1, Vimentin, Snail1, GAPDH의 primer를 반응시켜 PCR을 수행하였다. 각각의 primer sequences는 다음과 같다. PAI-1 forward primer, 5'-CAC AAG TCT GAT GGC AGC AC-3'; PAI-1 backward primer, 5'-CAG GCA TGC CCA ACT TCT C-3'; Vimentin forward primer, 5'-CAG CAG TAT GAA AGC GTG G-3'; Vimentin backward primer, 5'-GGA AGA AAA GGT TGG CAG AG-3'; Snail1 forward primer, 5'-AGC TGG CCA GGC TCT CGG-3'; Snail1 backward primer, 5'-TAG CTG GGT CAG CGA GGG-3'; GAPDH forward primer, 5'-GTG GAC ATT GTT GCC ATC AAC G-3'; GAPDH backward primer, 5'-GAG GGA GTT GTC ATA TTT CTC G-3. 증폭된 산물은 1% agarose gel에서 전기영동하여DNA의 발현 정도를 확인하였다.
면역 조직 화학 염색
신장조직은 적출 즉시 신우를 중심으로 장축으로 잘라 피막을 제거하고 그 반을 10% 포르말린에 24시간 동안 고정 시켰다. 계열 에탄올로 탈수한 후 파라핀 포매기(Leica EG116)에 포매하여 마이크로톰(Leica 820)으로 4μm두께로 절편을 제작하여 부착제가 처리된 슬라이드에 붙였다. 조직 슬라이드를 탈파라핀화시킨 후 에탄올과 증류수를 사용하여 함수시킨 뒤 메탄올에 희석한 3% 과산화수소 용액에 30분간 처리하여 내인성 과산화효소에 대한 반응을 차단하고 0.01M 인산염 완충액에서 10분간 세척하였다. 미리 데워놓은 95°C Dako Epitope Retrieval Solution(0.01mol/L citrate buffer, pH 6.0)에 조직절편이 충분히 잠기게 넣은 후 10분간 끓여 epitope retrieval 과정을 시행하고 실온에서 식힌 후 PBS로 세척 해 주었다. Antifibroblast specific protein (FSP)-1, anti-β-catenin, antiintegrin-liked kinase (ILK, Abcam, MA, USA) 에 대한 1차 항체를 4°C에서 16시간 동안 반응시키고, PBS로 세척한 후 biotinylated anti-goat IgG 또는 anti-mouse IgG(DAKO, CA, USA)를 2차 항체로 사용하여 37°C에서 15분간 반응시켰다. Streptoavidin peroxidase (DAKO)로 37°C에서 15분간 반응시키고, DAB (3,3′-diaminobenzi-dine tetrahydrochloride)로 발색한 후 hemotoxylin으로 대조 염색을 하여 광학현미경으로 관찰하였다.
면역형광염색
조직 슬라이드를 탈파라핀화 시킨 후 에탄올과 증류수를 사용하여 함수시킨 뒤 메탄올에 희석한 3% 과산화수소 용액에 30분간 처리하여 내인성 과산화효소에 대한 반응을 차단하고 PBS로 세척하였다. 단백분해효소인 proteinase K를 37°C에서 20분간 처리하여 포르말린 고정에 의하여 형성된 교차결합을 원상태로 되돌린 후 PBS로 2분씩 3번 세척하였다. Ecadherin(Cell signaling, MA, USA), Vimentin (BD Biosciences, CA, USA) 1차 항체를 항체 희석액에 1:100으로 희석하여 상온에서 1시간 반응시킨 후 PBS로세척하였다. 2차 항체는 FITC-conjugated anti-rabbit IgG와 TRITC-conjugated anti-mouse IgG (Sigma, St. Louis, USA)를 1:200으로 희석하여 상온에서 1~2시간 반응시킨 후 PBS로 세척하였다. Hoechst 33342를 PBS에 1:200으로 희석하여 37°C에서 20분간 반응시켜 대조염색한 후 형광현미경으로 관찰하였다.
통계적 분석
실험의 분석결과는 각각의 군별로 평균과 표준편차(mean±S.D.)를 사용하여 표기하였으며, 모든 자료는 SPSS 프로그램(Statistical Package for Social Science, SPSS Inc., Chicago, IL, USA)을 이용하여 처리하였고, 반복측정에 의한 ANOVA test를 적용하여 유의도 수준 p<0.05에서 확인하였다.
결 과
봉독이 UUO로 유도된 신섬유화에 미치는 영향
본 연구에서는 신섬유화 동물모델을 확립하기 위하여 마우스의 좌측 요관을 결찰하여 신섬유화를 유도하였으며, 봉독을 투여하여 봉독이 신섬유화에 미치는 영향을 관찰하였다. 신섬유화 관련 인자인 FSP-1의 발현변화를 면역조직화학염색을 통해 확인하였다(Fig. 1A). FSP-1의 발현은 정상대조군에 비하여 UUO군에서 현저하게 증가하여, 신섬유화가 유도된 것을 확인할 수 있었다. 그러나 봉독을 투여 한 후 FSP-1의 발현은 확연하게 감소되었다. RNA수준에서 봉독의 신섬유화 억제효과를 확인하기 위하여 신섬유화 관련 인자인 PAI-1과 Vimentin의 발현변화를 확인하였다. UUO군에서 PAI-1과 Vimentin의 발현양은 증가하였으나, 봉독을 투여하였을 때 이들의 발현양은 현저하게 감소함을 관찰할 수 있었다(Fig. 1B). 이러한 결과는 봉독이 신섬유화 관련 인자들을 억제하여 신섬유화 예방에 효과가 있을 것으로 사료된다.
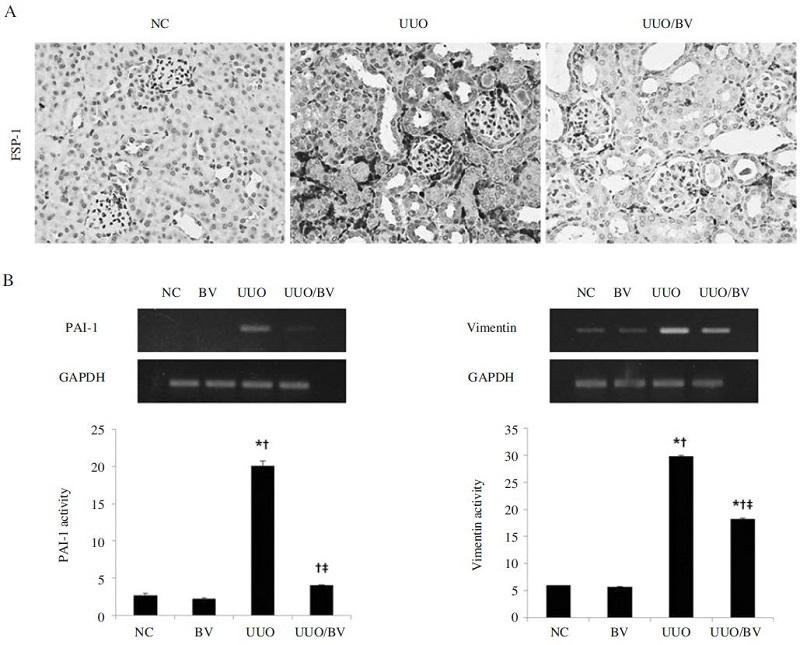
BV effectively inhibits renal fibrosis related gene in obstructed kidneys. (A) Representative immunohistochemical staining results for FSP-1 in the kidneys at 7 days after UUO. Magnification ×400. (B) RT-PCR results showed that BV suppresses the mRNA expression of PAI-1 and Vimentin in UUO kidneys. GAPDH was used to confirm equal sample loading. Results are expressed as mean ± S.E. of three independent determinations. NC, normal control; UUO, kidney injury induced by UUO; UUO/BV, UUO treated with 0.01mg/kg of BV.*p< 0.05 compared NC group, p< 0.05 compared BV group, p< 0.05 compared UUO group.
봉독이 EMT 과정에 미치는 영향
ILK의 발현은 핵 내의 β-catenin의 발현을 증가시켜 EMT를 진행시키는 것으로 알려져 있다(박, 2004). 이에, 면역조직화학염색을 통하여 ILK와 β-catenin의 발현을 확인한 결과, ILK의 발현은 UUO군에서 증가하였으나 봉독의 투여로 이의 발현이 현저히 감소함을 관찰할 수 있었다. 또한, UUO군에서 β-catenin은 세뇨관 상피세포의 세포질과 핵 내에서 발현이 증가하였으며, 봉독의 투여는 β-catenin의 발현을 감소시켰다(Fig. 2A). Snail1은 EMT 현상을 조절하는 중요한 전사인자로서, 상피세포 표지자인 E-cadherin의 전사를 억제하여 EMT를 촉진하는 것으로 알려져 있다(Saito et al., 2004; Yang et al., 2007). UUO군에서 Snail1의 발현이 증가하였으나, 봉독을 투여한 군에서는 이의 발현이 현저히 감소하였다(Fig. 2B). 따라서, 봉독은 ILK를 조절하여 β-catenin과 Snail1의 발현을 약화시킴으로써 EMT 현상을 억제하는 효과가 있는 것으로 사료된다.
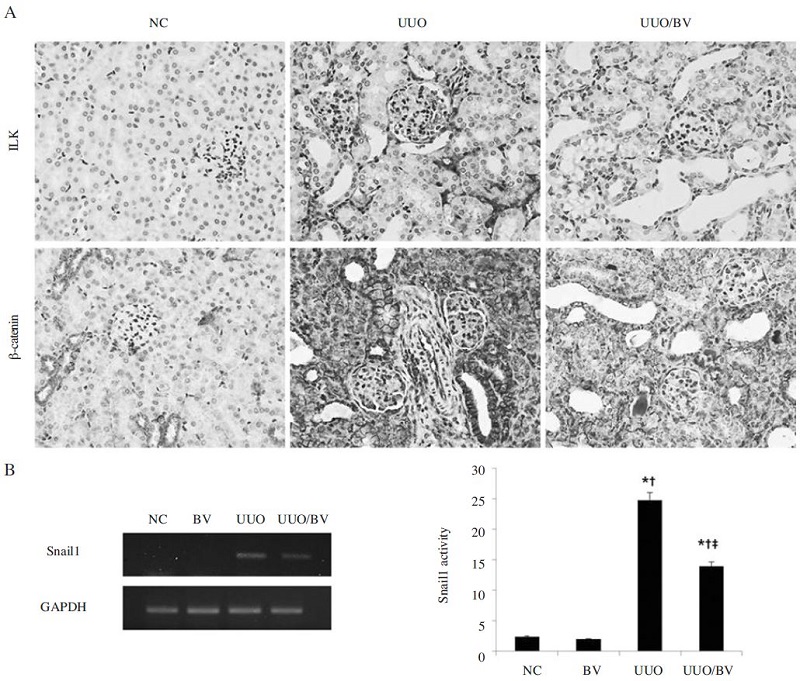
BV attenuates the expression of EMT related gene in obstructed kidneys. (A) Representative immunohistochemical staining results for ILK and β-catenin in the kidneys at 7 days after UUO. Magnification ×400. (B) RT-PCR results showed that BV suppresses the mRNA expression of Snail1 in uuo kidneys. GAPDH was used to confirm equal sample loading. Results are expressed as mean±S.E. of three independent determinations. NC, normal control; UUO, kidney injury induced by UUO; UUO/BV, UUO treated with 0.01mg/kg of BV.*p< 0.05 compared NC group, p< 0.05 compared BV group, p< 0.05 compared UUO group.
봉독이 EMT 표지자인 E-cadherin과 Vimentin 발현에 미치는 영향
일반적으로 EMT 과정에서 상피세포 표지자인 Ecadherin의 발현이 감소되고 기질세포 표지자인 Vimentin의 발현은 증가하게 된다. E-cadherin과 Vimentin의 발현변화는 EMT 현상의 가장 중요한 특징이다(김, 2012). 이에 따라 본 연구에서는 신섬유화 과정에서 봉독의 EMT 억제효과를 확인하기 위하여 EMT 현상을 나타내는 표지자인 E-cadherin과 Vimentin의 발현변화를 면역형광염색을 통해 확인하였다(Fig. 3). 정상군과 비교하였을 때, UUO군에서 Ecadherin 발현은 감소하고 Vimentin의 발현은 증가함을 관찰하여, UUO를 통하여 EMT가 일어남을 확인할 수 있었다. 그러나 봉독의 투여는 정상군과 유사하게 세포 표면의 E-cadherin의 발현을 증가시키며, 세포질의 Vimentin의 발현을 감소시켰다. 이 결과는 앞선 결과와 함께 봉독이 EMT를 차단하여 신섬유화를 억제하는 효과가 있는 것으로 사료된다.
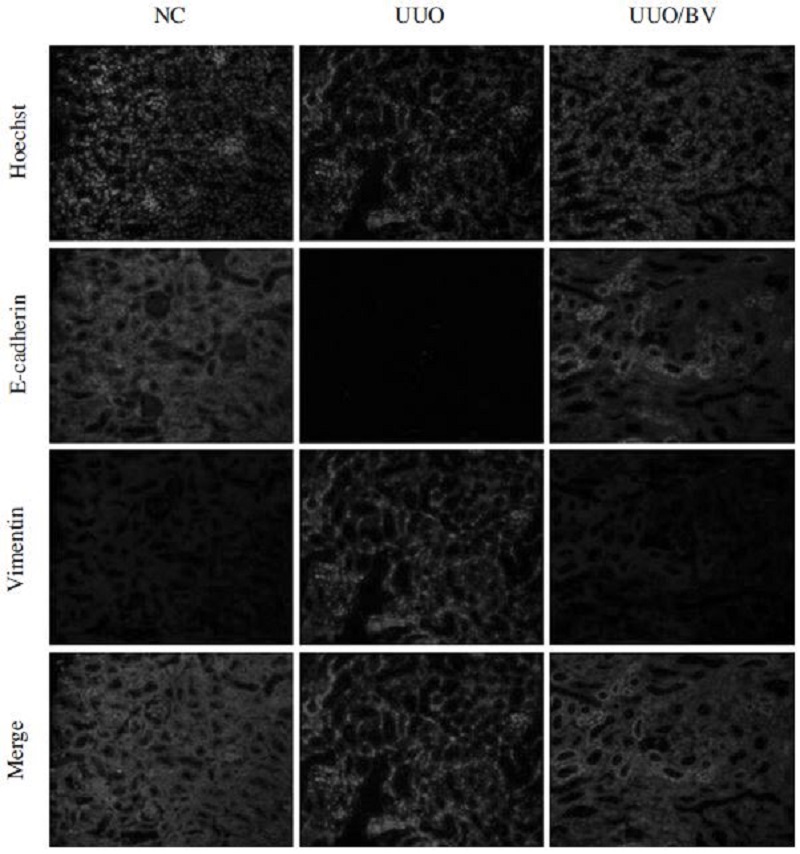
BV abolishes the EMT in obstructed kidneys. Representative immunofluorescence images show that BV treatment suppresses Vimentin and increases E-cadherin in the UUO kidney. Immunofluorescence double staining for E-cadherin (green), Vimentin (red), and nuclei were counterstained with Hoechst 33342 (blue) in UUO kidenys. Magnification×200. NC, normal control; UUO, kidney injury induced by UUO; UUO/BV, UUO treated with 0.01mg/kg of BV.
고 찰
봉독은 예로부터 봉침요법 등 민간요법으로 근육통, 급·만성관절염, 신경통, 통풍, 화농성 질환, 두통, 피부병, 간질환 등에 적용되었다(Lee et al., 2003). 특히, 봉독은 진통 및 소염의 효능이 탁월한 것으로 알려져 있으나, 과민반응 등 부작용의 가능성이 있어 효과 및 안전성을 알기 위하여 체계적인 시험이 필요한 실정이다(Valetine, 1984). 봉독에 관한 연구는 1990년대 이후부터 활발히 진행되고 있으며, 항암효과, 간경화 억제효과를 포함한 다양한 생리 및 약리 작용에 관한 기전이 점차 알려지고 있다(Sakamoto et al., 1996).
본 연구에서는 봉독이 신섬유화에 미치는 영향을 알아보고자 UUO로 유도된 신섬유화 동물모델에 봉독을 투여하여, 신섬유화 관련 인자(FSP-1, PAI-1, Vimentin)를 다양한 실험 기법으로 확인하였다. FSP-1은 정상 신조직에서는 섬유화세포에서 발현되며, 섬유화가 진행되는 신조직에서는 섬유화세포 외 염증 주위의 상피세포에서도 발현된다고 알려져 있다(박, 2004). 이러한 FSP-1의 발현은 UUO군에서 증가하였으나, 봉독을 투여하였을 때 현저하게 감소함을 관찰하였다. 신섬유화 과정에서 ECM의 분해를 억제하여 ECM의 축적을 유도하는 PAI-1과(구, 2001), 기질세포 표지자인 Vimentin의 발현양 또한 UUO군에서 증가하였고, 봉독을 투여하였을 때 감소함을 확인하였다. 이러한 결과는 봉독이 신섬유화 예방 및 치료에 효과가 있을 것으로 사료된다.
신섬유화 등의 섬유화 질환에서 EMT는 중요한 역할을 한다고 알려져 있다(Margetts et al., 2005; Kalluri and Neilson, 2003). 이러한 EMT 과정에 ILK는 직접 또는 간접적으로EMT의 모든 과정에 참여한다(Li et al., 2003). 신섬유화로 인해 활성화된 ILK는 GSK-3를 인산화시키고, 인산화된 GSK-3는 β-catenin을 안정화시킨다. 안정화된 β-catenin은 핵 내로 이동하여 EMT를 진행시킨다(박, 2004). β-catenin은 세뇨관 상피세포에서 EMT를 유발하며, 섬유화 관련 인자인 Snail1, PAI-1, MMP-7, fibronectin 등의 발현을 증가 시키는 것으로 알려져 있다(He et al., 2012; Hao et al., 2011; He et al., 2010). 본 연구에서는 신섬유화로 인한 EMT 과정에서 봉독의 효과를 확인하기 위하여 ILK, β-catenin, Snail1의 발현변화를 관찰하였다. 이들의 발현은 UUO군에서 증가하였으며 봉독을 처리하였을 때 현저하게 감소하였다. 이러한 결과는 봉독이EMT를 억제하는 효과가 있음을 나타낸다.
신장의 상피세포가 발생기간 동안 중간엽세포의 상피세포화(mesenchymal-epithelial transition, MET)로 형성된 점을 생각할 때, 섬유화로 인한 EMT는 발생과정을 역행하는 것이라고 볼 수 있다(Horster et al., 1999). EMT 과정에서 상피세포 표지자인 E-cadherin은 Ca2+ 의존적인 세포접착단백질 중 하나로 알려져 있으며, 세포와 세포의 상호 관계조절, 상피세포의 부착띠 연결에 중요한 역할을 한다(Takeno et al., 2004; Saito et al., 2004; Peinado et al., 2004). 본 연구에서 Ecadherin의 발현은 봉독을 처리함으로써 정상군과 유사하게 증가하였으며Vimentin의 발현은 감소하였다. EMT의 중요한 특징 중 하나인 E-cadherin과 Vimentin의 발현변화를 통해 봉독이 신섬유화 동물모델에서 EMT를 억제함을 확인하였다.
따라서, 본 연구의 결과 봉독은 UUO로 유도된 신섬유화 동물모델에서 섬유화 관련 인자들을 억제할 뿐만 아니라, EMT 과정도 억제하는 것을 관찰 할 수 있었다. 이로 미루어 봉독을 신섬유화의 예방 및 치료제로 사용할 가능성이 있는 것으로 사료된다.
Acknowledgments
본 논문은 농촌진흥청 연구사업(세부과제번호: PJ01132501)의 지원에 의해 이루어진 것임.
References
- 권영근, 이영국, 강일, 이은석, 박관규, 금윤섭, 김경현, 박재신, (2007), 편측성 완전 요관페색 생쥐모델에서 NFkappa B Decoy Oligodeoxynucleotide 투여효과, 대한비뇨기과학회지, 48(8), p815-25.
- 구자옥, (2001), Renal Interstitial Fibrosis와 Renin Angiotensin System Inhibition, 인제대학교 의과대학 상계백병원소아과, 44(3), p292-6.
- 김경현, 박지현, 김수정, 이우람, 여주홍, 한상미, 이광길, 박관규, (2009), 봉독이 고콜레스테롤 식이 투여 마우스의 지질 대사 및 간기능에 미치는 영향, 한국양봉학회지, 24(3), p179-89.
- 김민경, (2012), 신 섬유화 과정에서 상피-기질세포 전환에 관여하는 물질들의 발현양상: 면역 조직 화학법을 통한 연구, 경북대학교 대학원 학위논문.
- 박선희, (2004), Epithelial-Mesenchymal Transition (EMT) in Renal Disease Progression, 대한신장학회지, 23(2), p510-6.
- 박지현, 김경현, 한상미, 여주홍, 박관규, 이광길, (2007), 봉독이 간경화 동물모델에 미치는 영향, 한국양봉학회지, 22, p173-9.
- 윤종우, 조상경, 한상엽, 차대룡, 조원용, 김형규, 원남희, (2002), 일측 요관폐쇄 백서에서 안지오텐신 전환효소 억제제와 안지오텐신 수용체차단체의 병합사용이 신세뇨관 간질손상 기전에 미치는 영향에 대한 연구, 대한신장학회지, 21(2), p232-43.
-
Blechschmidt, K., Sassen, S., Schmalfeldt, B., Schuster, T., Hofler, H., and Becker, K. F., (2008), The E-cadherin repressor Snail is associated with lower overall survival of ovarian cancer patients, Br. J. Cancer, 29(98), p489-95.
[https://doi.org/10.1038/sj.bjc.6604115]

-
Diamond, J. R., (1995), Macrophages and progressive renal disease in experimental hydronephrosis, Am. J. Kidney Dis, 26(1), p133-40.
[https://doi.org/10.1016/0272-6386(95)90166-3]

- Diamond, J. R., Ricardo, S. D., and Klahr, S., (1998), Mechanisms of interstitial fibrosis in obstructive nephropathy, Seminars in Nephrology, 18(6), p594-602.
-
Hao, S., He, W., Li, Y., Ding, H., Hou, Y., Nie, J., Hou, F. F., Kahn, M., and Liu, Y., (2011), Targeted inhibition of β-catenin/CBP signaling ameliorates renal interstitial fibrosis, J. Am. Soc. Nephrol, 22(9), p1642-53.
[https://doi.org/10.1681/ASN.2010101079]

- Harris, K. P., Klahr, S., and Schreiner, G., (1993), Obstructive nephropathy: from mechanical disturbance to immune activation?, Exp. Nephrol, 1(3), p198-204.
-
He, W., Tan, R., Dai, C., Li, Y., Wang, D., Hao, S., Kahn, M., and Liu, Y., (2010), Plasminogen activator inhibitor-1 is a transcriptional target of the canonical pathway of Wnt/β- catenin signaling, J. Biol. Chem, 285(32), p24665-75.
[https://doi.org/10.1074/jbc.M109.091256]

-
He, W., Tan, R. J., Li, Y., Wang, D., Nie, J., Hou, F. F., and Liu, Y., (2012), Matrix metalloproteinase-7 as a surrogate marker predicts renal Wnt/β-catenin activity in CKD, J. Am. Soc. Nephrol, 23, p294-304.
[https://doi.org/10.1681/ASN.2011050490]

- Horster, M. F., Braun, G. S., and Huber, S. M., (1999), Embryonic renal epithelia: induction, nephrogenesis, and cell differentiation, Physiol. Rev, 79(4), p1157-91.
-
Kalluri, R., and Neilson, E. G., (2003), Epithelial-mesenchymal transition and its implications for fibrosis, J. Clin. Invest, 112(12), p1776-84.
[https://doi.org/10.1172/JCI200320530]

- Kim, J. Y., Koh, H. K., Kim, Y. S., Park, Y. B., Kim, C. H., and Kang, S. K., (1997), Reviews of recent research on bee venom therapy, The Acupuncture, 14(2), p47-71.
-
Klahr, S., (1991), New insights into the consequences and mechanisms of renal impairment in obstructive nephropathy, Am. J. Kidney Dis, 18(6), p689-99.
[https://doi.org/10.1016/S0272-6386(12)80611-1]

- Klahr, S., and Morrissey, J. J., (1998), The role of growth factors, cytokines, and vasoactive compounds in obstructive nephropathy, Seminars in Nephrology, 18(6), p622-32.
- Lee, H. S., Lee, J. D., and Koh, H. K., (2003), The review on the study of bee venom in the domestic papers, J. Kor. Acupuncture Moxibustion Soc, 20, p154-165.
-
Li, Y., Yang, J., Dai, C., Wu, C., and Liu, Y., (2003), Role for integrinlinked kinase in mediating tubular epithelial to mesenchymal transition and renal interstitial fibrogenesis, J. Clin. Invest, 112(4), p503-16.
[https://doi.org/10.1172/JCI200317913]

-
Margetts, P. J., Bonniaud, P., Liu, L., Hoff, C. M., Holmes, C. J., West-Mays, J. A., and Kelly, M. M., (2005), Transient overexpression of TGF-{beta}1 induces epithelial mesenchymal transition in the rodent peritoneum, J. Am. Soc. Nephrol, 16(2), p425-36.
[https://doi.org/10.1681/ASN.2004060436]

- Michael, Z., Amish, A. S., and Raghu, K., (2004), Bone Morphogenic Protein-7 Induces Mesenchymal to Epithelial Transition in Adult Renal Fibroblasts and Facilitates Regeneration of Injured Kidney, J. Biol. Chem, 280, p8094-100.
-
Nakaya, Y., Sukowati, E. W., Wu, Y., and Sheng, G., (2008), RhoA and microtubule dynamics control cell-basement membrane interaction in EMT during gastrulation, Nat. Cell Biol, 10(7), p765-75.
[https://doi.org/10.1038/ncb1739]

-
Peinado, H., Portillo, F., and Cano, A., (2004), Transcriptional regulation of cadherins during development and carcinogenesis, Int. J. Dev. Biol, 48, p365-75.
[https://doi.org/10.1387/ijdb.041794hp]

-
Saito, T., Oda, Y., Kawaguchi, K., Sugimachi, K., Yamamoto, H., Tateishi, N., Tanaka, K., Matsuda, S., Iwamoto, Y., Ladanyi, M., and Tsuneyoshi, M., (2004), E-cadherin mutation and Snail overexpression as alternative mechanisms of E-cadherin inactivation in synovial sarcoma, Oncogene, 23(53), p8629-38.
[https://doi.org/10.1038/sj.onc.1207960]

-
Sakamoto, T., Repasky, W. T., Uchida, K., Hirata, A., and Hirata, F., (1996), Modulation of cell death pathways to apoptosis and necrosis Of H2O2-treated rat thymocytes by lipocortin I, Biochem. Biophys. Res. Commun, 220(3), p643-7.
[https://doi.org/10.1006/bbrc.1996.0457]

- Smithies, and Robert, L. C., (1999), Reduced angiotensinogen expression attenuates renal interstitial fibrosis in obstructive nephropathy in mice, J. Clin. Invest, 103(1), p39-46.
-
Takeno, S., Noguchi, T., Fumoto, S., Kimura, Y., Shibata, T., and Kawahara, K., (2004), E-cadherin expression in patients with esophageal squamous cell carcinoma: promoter hypermethylation, Snail overexpression, and clinicopathologic implications, Am. J. Clin. Pathol, 122(1), p78-84.
[https://doi.org/10.1309/WJL90JPEM17RBUHT]

-
Valetine, M. D., (1984), Insect venom allergy: diagnosis and treatment, J. Allergy Cli. Immunol, 73, p299-304.
[https://doi.org/10.1016/0091-6749(84)90397-X]

-
Yang, M. H., Chang, S. Y., Chiou, S. H., Liu, C. J., Chi, C. W., Chen, P. M., Teng, S. C., and Wu, K. J., (2007), Overexpression of NBS1 induces epithelial-mesenchymal transition and co-expression of NBS1 and Snail predicts metastasis of head and neck cancer, Oncogene, 26(10), p1459-67.
[https://doi.org/10.1038/sj.onc.1209929]
