
여드름 균으로 유도된 염증성 동물모델에서 봉독과 클린다마이신의 효능 비교
Abstract
Acne is the most common skin disease, causing significant psychosocial problems for those afflicted. Currently, available agents for acne treatment have limited to use with antibiotics, which cause side effects or resistance. Bee venom (BV) has traditionally been used as a treatment for a wide variety of ailments such as inflammatory diseases. Despite its well documented antiinflammatory property, it has not been fully demonstrated regarding the influence of BV against inflammatory acne. This study evaluated the anti-inflammatory property of BV and clindamycin, which is well-known antibiotics against acne treatment. To induce inflammation in vivo using Propionibactierium acnes (P. acnes), 1×107 CFU of living P. acnes were intradermally injected into the ear of mice. BV (50, 100, 200 and 400μg/g) in gel and clindamycin (1%) was applied epicutaneously on the ear. Epicutaneous administration of BV or clindamycin decreased the number of infiltrated inflammatory cells and inflammatory cytokines in the ear, thereby relieving P. acnes-induced ear swelling and subsequent proinflammatory cytokine expression, especially at the dose of 200μg/g of BV. The anti-inflammatory effects of BV is relatively same or superior compared to those of clindamycin in P. acnes-induced inflammation in vivo. These results demonstrate that the potential of using BV as an alternative treatment to the antibiotic therapy of acne.
Keywords:
Bee venom, Propionibactierium acnes, Clindamycin, Inflammation, Skin서 론
여드름은 주로 얼굴, 가슴, 목, 어깨 등에서 발생하는 모낭피지선의 염증으로 면포, 구진, 농포 및 결절을 형성하여 심한 경우 반흔을 남기는 대표적인 염증성 피부 질환이다. 일반적으로 여드름은 주로 청소년기의 호르몬 변화로 청소년들에게 많이 발생하였으나 최근에는 식습관의 변화로 발병 연령층이 나이와 관계없이 넓어지고 있는 실정이다. 여드름의 발생은 피지 생산의 증가, 피부 상재 세균의 모낭 증식 및 유전적 소질 등의 다양한 인자들이 복합적으로 작용하여 발생하는 것으로 알려져 있다(Van de kerkhof et al., 2006; Freak, 2006; Taub, 2007). 여드름에 관여하는 피부 상재균은 Staphylococcus epidermis, Staphylococcus aureus, Staphylococcus pyogen, Propionibacterium acnes(P. acnes) 등이 있으며, 그 중 P. acnes는 대표적인 여드름 원인균으로 알려져 있다. 혐기성 세균인 P. acnes는 피부 내의 과잉된 피지로 막힌 모낭 내에서 증식하며 피부 내의 단핵구세포를 활성화시켜 염증관련 사이토카인의 분비를 촉진하여 피부 내 염증을 증가시키는 것으로 알려져 있다(Webster and Leyden, 1980; Vowels et al., 1995; Cunliffe et al., 2004).
여드름 치료는 증상이 경미할 경우 국소도포요법을 사용하며, 증상이 심할 경우 국소도포요법과 함께 경구요법을 병행하여 치료하는 것이 효과적이다. 주로 여드름 치료에 이용되는 항생제는 테트라사이클린계 또는 클린다마이신 계열을 많이 사용하고 있으나, 이들 화학적 항생제는 장기간 투여 시 부작용을 유발하거나 여드름 유발균에 대한 내성이 발생하게 되는 단점을 갖고 있다(Lim et al., 1995). 이러한 문제점을 극복하기 위하여 독성과 부작용이 없으며 항균활성 및 항염 효과를 함유하는 천연물에 대한 연구가 국내외에서 활발하게 진행되고 있다.
천연물 유래의 항균물질은 약리효과가 높고 부작용이 낮아 이에 대한 다양한 연구가 수행되고 있다(이 등, 2011; 임과 강, 2009). 대표적인 천연물질로 알려진 봉독은 강력한 항균, 항염증, 항암효과를 포함한 다양한 생리 및 약리작용을 가지고 있는 것으로 알려져 있다(Son et al., 2007). 봉독은 꿀벌(Apis mellifera)의 독낭에 들어있는 약 40여 가지의 유효성분으로 구성된 물질로 성분은 크게 peptide components, non peptide components, enzyme 등으로 구성되어 있다(Habermann, 1971). 전통적으로 봉독은 봉침요법을 통하여 관절염을 비롯한 염증성 질환 및 통증성 질환에 주로 사용되어 왔다(Dunn and Killion, 1998). 특히, 봉독은 항염증 효과가 탁월한 것으로 알려져 있는데, 박등의연구에서는 염증으로 유도되는 대표적인 만성질환인 간경화 동물모델에서 봉독의 치료 효과에 대한 가능성을 제시한 바 있으며 한 등의 연구에서는 염증을 유도한 대식세포에서 봉독이 nitric oxide (NO)와 tumor necrosis factor (TNF)-α의 발현을 억제시킴으로써 항염증 작용에 효과가 있음을 보고한 바 있다(박 등, 2007; 한 등 2009). 이 외에도 다양한 염증성 질환에서 봉독의 효능에 관한 연구가 이루어지고 있으나 대표적인 염증성 피부질환 중 하나인 여드름 치료제로서 봉독의 효능에 대한 연구는 미비한 실정이다.
천연물 유래의 여드름 치료제 개발에 대한 연구는 다양하게 이루어지고 있으나 실제로 제품화까지 이어지는 경우는 많지 않다(Burton and Shuster, 1971; 김 등, 2006; 임 등, 2009). 따라서, 본 연구에서는 염증성 피부질환 동물모델을 이용하여 천연물인 봉독과 대표적인 화학적인 항생제인 클린다마이신을 투여하여 여드름 치료제로서 봉독의 효능을 비교!⁄검정하고자 한다.
재료 및 방법
시험물질
본 실험에 사용한 봉독은 농촌진흥청의 국립농업과학원에서 사육 중인 서양종 꿀벌(Apis mellifera)로부터 봉독채집장치(청진테크, 안산, 한국)를 이용하여 봉독을 분리하였고, 불순물을 제거하여 순수 정제봉독(purified bee venom)을 취하였다(한 등, 2005). 분리한 정제봉독은 50, 100, 200, 400μg/g의 농도로 겔(트롤아민, 카보머 등으로 구성 동성제약, 한국)에 희석하여 시험에 사용하였다. 시험에 사용한 클린다마이신(국전약품, 한국)은 1%의 농도(10mg/g)으로 동일한 겔에 희석하여 시험에 사용하였다.
사용 균주 및 배지 조성
본 연구에서 사용한 여드름 원인균인 P. acnes(ATCC 6919)는 한국미생물균주은행으로부터 분양받아 사용하였다. P. acnes는 Reinforced Clostridium Medium (RCM, Oxford, Hampshire, England) 배지에 37°C에 OD600=1.0가 되도록 혐기 조건으로 1~2일 배양하여 4°C에서 보관하여 실험에 사용하였다.
실험동물 및 여드름 유발
실험동물은 체중 20g 내외의 생후 7주 수컷 BALB/c 마우스를 샘타코 BIO KOREA(오산, 경기도, 대한민국)로 부터 제공 받았고 7일간 적응시켰다. 실험용 마우스는 5마리씩 9군으로 나누어 군 별로 cage에 분리시키고 각각의 사료와 물을 자유롭게 섭취하도록 하였다. 정상대조군은 마우스의 양쪽 귀에 20μl의 PBS를 피내 주사하였다. 염증반응유도군은 마우스의 양쪽 귀에 P. acnes(1×107 CFU/20μl in PBS)를 피내 주사하였다. Placebo 군은 마우스의 양쪽 귀에 P. acnes (1×107 CFU/20μl in PBS)를 피내 주사한 후, 오른쪽 귀에 약제를 함유하지 않은 겔을 0.1g 도포하였다. 클린다마이신 투여군은 마우스의 양쪽 귀에 P. acnes(1×107 CFU/20μl in PBS)를 피내 주사한 후, 오른쪽 귀에 1% 클린다마이신(10mg/g)을 함유한 겔을 0.1g 도포하였다. 봉독투여군은 마우스의 양쪽 귀에 P. acnes(1×107 CFU/20μl in PBS)를 피내 주사한 후, 오른쪽 귀에 봉독(50, 100, 150, 200, 400μg/g)을 함유한 겔 0.1g을 도포하였다. 또한, 봉독과 클린다마이신의 효능을 비교하기 위한 시험을 위하여 마우스의 양쪽 귀에 P. acnes (1×107 CFU/20μl in PBS)를 피내 주사한 후, 오른쪽 귀에는 200μg/g의 봉독함유 겔과 왼쪽 귀에는 1% 클린다마이신 함유 겔을 각각 0.1g씩 도포하였다. 각 군의 마우스는 실험시작 24시간 후 경추탈골로 희생시킨 후 귀 조직을 적출하였다.
조직검사
귀 조직은 절제하여 10% 포르말린에 고정시켰다. 충분한 고정과정을 거친 귀 조직은 일련의 조직처리 과정을 거친 후 파라핀 포매기(Leica EG116)에 포매하여 마이크로톰(Leica 820)으로 4μm 두께의 절편을 제작한 다음 Hematoxylin & Eosin (H&E) 염색을 하여 광학현미경으로 관찰하였다.
단백질 분리와 Western blot 분석
분리한 귀 조직은 변성용액(IPH lysis buffer, 50mM pH 8.0 Tris, 150mM NaCl, 5mM EDTA, 0.5% NP-40, 100mM PMSF, 1mg/ml leupeptin, 1mg/ml aprotinin and 1M DTT)을 첨가한 후, 조직 분쇄기로 조직을 파괴시키고 12,000rpm에서 30분 동안 원심 분리 후 단백질을 분리하였다. 분리한 단백질을 Bradford 법(Bio-Rad Laboratories, CA, USA)으로 정량하였으며, 정량한 단백질은 SDS-PAGE로 전기영동하고 PVDF membrane(Milipore, MA, USA)에 옮겼다. Membrane은 일차 항체 Interleukin (IL)-8, IL-1β, Tumor necrosis factor (TNF)-α, Toll-like receptor (TLR)-2, phosphorylated-Nuclear factor (NF)-κB, GAPDH, β-actin (Santa Cruz Biotechnology, CA, USA)와 4시간 반응시키고 TBS-T로 10분간 3회 세척 후 membrane을 각각의 2차 항체로 2 시간 반응시켰다. 항체들에 대한 발현 분석은 horseradish peroxidaselinked (HRP) 이차항체에 의해 발현되는 enhanced chemiluminescence (ECL) Western Blot Analysis (Amersham, NJ, USA)시스템을 이용하였으며 X-ray 필름에 현상한 후 Science Lab 2005 (Fujifilm, Japan)를 이용하여 비교·분석 하였다.
통계처리: 실험의 분석결과는 각각의 군별로 평균과 표준편차(mean±S.D.)를 사용하여 표기하였으며, 모든 자료는 SPSS 프로그램(Statistical Package for Social Science, SPSS Inc., Chicago, IL, USA)을 이용하여 처리하였고, 반복측정에 의한 ANOVA test를 적용하여 유의도 수준 p<0.05에서 확인하였다.
결과 및 고찰
P. acnes로 유도된 염증유발 동물모델에서 클린다마이신의 효력 시험
혐기성 세균인 P. acnes는 대표적인 여드름 원인균으로서 피부 내의 과잉된 피지로 막힌 모낭 내에서 증식하여 피부 내의 염증을 증가시키는 것으로 알려져 있다(Van de kerkhof et al., 2006; Freak, 2006; Taub, 2007). 이 등의 연구에서 사용한 P. acnes로 유도된 염증유발 동물모델을 이용하여 여드름 질환에서 봉독 및 클린다마이신의 효력을 검정하고자 하였다(이 등, 2011). 실험 마우스의 양쪽 귀에 P. acnes를 피내 주사하여 염증성 피부질환을 유도하였고, 오른쪽 귀에는 약제를 도포하여 각 군에서 약제의 효력을 관찰하고자 하였다. 먼저 시험약제가 들어가지 않은 상태의 겔을 도포하였을 때(placebo 군), 겔은 실험마우스의 양쪽 귀의 염증반응에아무런영향을주지않은것을확인하였다.
일반적으로 여드름 치료에는 테트라사이클린, 클린다마이신 등의 항생제를 많이 사용하고 있다(Gollnick et al., 2003; Whitney and Ditre, 2011). 본 연구에서는 여드름 치료제로서 천연물인 봉독과 항생제인 클린다마이신의 효력을 비교하고자 하였다. 먼저 시판 여드름 약제인 클린다마이신의 효능을 살펴보았다. 클린다마이신 1%(10mg/g)를 함유한 겔을 도포한 군(clindamycin 군)에서는 P. acnes로 유도된 염증반응이 현저히 감소함을 육안상으로 관찰하였다. 또한, 클린다마이신의 투여로 염증으로 두꺼워진 귀조직의 두께가 감소하며, 농양형성 및 염증세포의 침윤이 완화됨을 관찰할 수 있었다(Fig. 1).
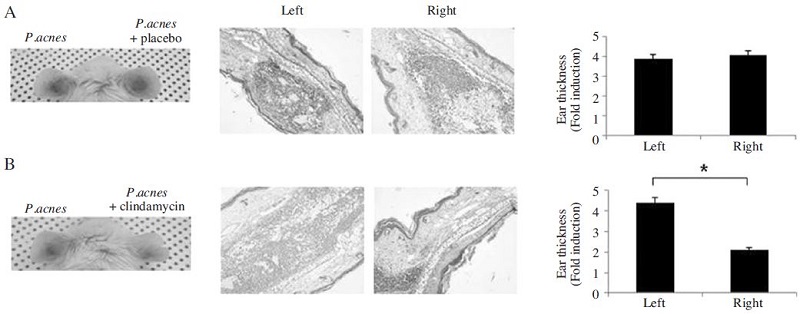
Effect of epicutaneous administration of placebo and clindamycin on P. acnes-induced inflammation. Ears of Balb/c mice were injected intradermally with 1×107 CFU/20μl of P. acnes and epicutaneous administration of placebo (A) or clindamycin (B). Epicutaneous administration of placebo with P. acnes does not change the inflammatory changes in the ear, while clindamycin treatment suppresses P. acnes-induced ear swelling and granulomatous inflammation. Representative images from each study group. (Left) Inflammation-induced ear redness was visualized at 24 hours after injection. (Middle) Histological changes of P. acnes with placebo or clindamycin administration were observed by H&E staining. (Right) Ear thickness was measured by H&E staining. P. acnes-injected ear serves as a control. Magnification ×100. Data were expressed as means±S.E. of three independent determinations. *p<0.05 vs P. acnes-injected ear.
P. acnes로 유도된 염증유발 동물모델에서 농도별 봉독의 효력 시험
P. acnes로 유도된 염증유발 동물모델에서 봉독의 농도별 효력을 시험하기 위하여 다양한 농도의 봉독을 함유하는 겔(50, 100, 200, 400μg/g)을 마우스의 오른쪽 귀에 도포하였다. P. acnes의 투여로 실험 마우스의왼쪽귀는붉게부풀어있으며, 염증반응이 일어남을 확인할 수 있었다. 반면 다양한 농도의 봉독을 함유하는 겔(50, 100, 200, 400μg/g)을 함께 처리한 오른쪽 귀는 왼쪽 귀보다 염증 반응이 현저히 완화됨을 관찰할 수 있었다(Fig. 2).
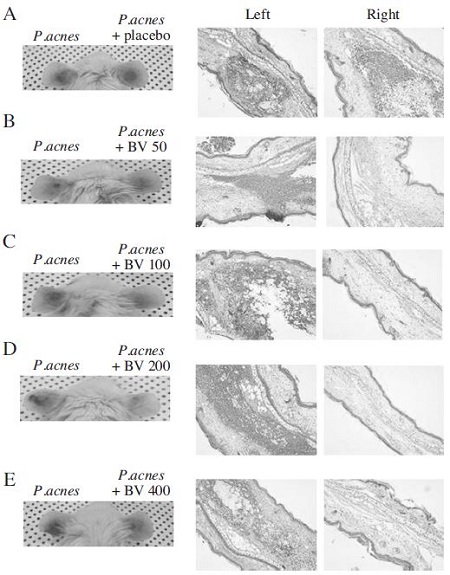
Effect of epicutaneous administration of bee venom on P. acnes-induced inflammation. Ears of Balb/c mice were injected intradermally with 1×107 CFU/20μl of P. acnes and epicutaneous administration of bee venom (A: placebo, B: 50μg/g of bee venom, C: 100μg/g of bee venom, D: 200μg/g of bee venom and E: 400μg/g of bee venom). Epicutaneous administration of bee venom with P. acnes decreased the inflammatory changes in the ear, which due to relieve P. acnes-induced ear swelling and granulomatous inflammation. Representative images from each study group. (Left) Inflammation-induced ear redness was visualized at 24 hours after injection. (Right) Histological changes of P. acnes with bee venom administration were observed by H&E staining.
또한, P. acnes의 투여로 유도된 염증세포의 침윤을 관찰하였을 때, 200μg/g의 봉독을 함유한 겔을 투여한 군에서 염증반응이 현저히 완화됨을 관찰할 수 있었다(Fig. 3A). H&E 염색을 통하여 관찰한 결과 P. acnes로 유도된 염증으로 두꺼워진 귀조직의 두께는 봉독의 투여로 감소하였다. 특히, 200μg/g의 봉독을 함유한 겔을 투여한 군에서 염증으로 두꺼워진 귀조직의 두께가 가장 많이 감소하였으며 이의 변화는 시판약제인 클린다마이신을 투여한 군과 거의 유사함을 관찰할 수 있었다(Fig. 3B). 따라서 봉독을 함유하는 겔은 P. acnes로 유도된 염증을 완화시키며 특히, 200μg/g의 농도의 봉독을 함유하는 겔을 투여하였을 때의 효력이 가장 탁월한 것으로 사료된다.
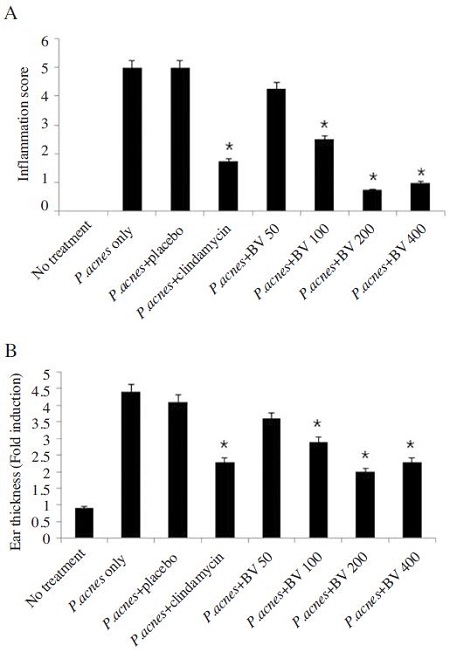
Comparison of the effect of bee venom and clindamycin bee venom on P. acnes-induced inflammation. Bee venom (50, 100, 200, 400μg/g) and clindamycin treatment reduces inflammatory changes and ear thickness induced by P. acnes injection. (A) Inflammation scores were determined by infiltration of inflammatory cells compared to P. acnesinjected ear in 5 random-independent field of H&E staining. (B) Ear thickness was measured by H&E staining. P. acnesinjected ear serves as a control. Data were expressed as means±S.E. of three independent determinations. *p<0.05 vs P. acnes-injected ear.
여드름 균 유도 염증유발 동물모델에서 봉독과 클린다마이신의 효력 비교
P. acnes로 유도된 염증은 클린다마이신과 봉독의 투여로 염증반응이 완화됨을 관찰하였다. 이와 같은 염증완화 현상의 분자생물학적 기전을 알아보기 위하여 실험동물의 조직에서 염증과 관련된 사이토카인의 발현변화를 살펴보았다. 일반적으로 P. acnes는 피부 각질세포와 단핵구 세포들의 염증관련 사이토카인의 발현을 증가시키는 것으로 알려져 있다. 그중 IL-8, IL-1β과 TNF-α는 대표적인 염증성 사이토카인으로 피부 단핵구 세포의 육아종을 형성을 촉진시켜 염증성 피부질환을 심화시키는 것으로 알려져 있다(Nathan, 1987; Salvemini et al., 1990). 또한, P. acnes는 TLR-2를 통하여 이와 같은 염증성 사이토카인의 발현을 조절한다는 것으로 알려져 있다. Western blot 결과를 통하여 염증이 유발된 귀조직에서는 염증관련 사이토카인(IL-8, IL-1β, TNF-α)과 TLR-2의 발현이 증가함을 관찰하였고, 200μg/g 농도의 봉독과 1%의 클린다마이신을 투여한 군에서는 이들의 발현이 현저히 감소함을 관찰할 수 있었다.
염증성 사이토카인인 IL-8, IL-1β과 TNF-α의 발현은 전사인자인 NF-κB의 발현에 의하여 조절된다. 전사인자인 NF-κB는 염증반응과 같은 세포자극에 의하여 세포질에서 핵 내로 인산화 되면서 활성화되어 다양한 염증성 사이토카인의 발현을 증가시킨다(Boone et al., 2002). NF-κB는 여드름으로 인한 염증성 피부조직에서도 발현이 증가하는 것으로 알려져 있다. 특히, 염증성 여드름 피부조직의 상피세포의 모낭과 그 주변 세포에서 NF-κB의 복합체는 IκBα의 인산화로 활성화되어 NF-κB가 핵 내로 이동하여 활성화되는 것으로 보고되고 있다(Kang et al., 2005; Yamamoto and Gaynor, 2001; Fisher et al., 1996).
P. acnes로 유도된 염증유발 피부조직에서 봉독과 클린다마이신의 염증성 사이토카인의 발현 조절을 관찰하기 위하여 전사인자 NF-κB의 핵 내 발현 변화를 관찰하였다. P. acnes의 투여로 활성화된 NF-κB가 증가되었으나, 클린다마이신과 봉독의 투여는 활성화된 NF-κB의 발현을 감소시키는 것을 관찰할 수 있었다. 따라서, 봉독은 염증관련 사이토카인 및 NF-κB 전사인자의 활성을 억제함으로서 염증성 피부질환을 완화시킴을 관찰할 수 있었고 봉독의 효능은 시판 약제인 클린다마이신의 효능과 거의 유사하거나 뛰어남을 관찰하였다(Fig. 4).

Effects of bee venom and clindamycin on the expression of inflammatory cytokine. Representative western blotting results showed that P. acnes-injection induces the expression of proinflammatory cytokines (IL-8. IL-β‚ and TNF-α), TLR2 and p-NF-κB. However, bee venom (200μg/g) or clindamycin (1%) treatment markedly inhibited the expression of proinflammatory cytokines (IL-8. IL-1β‚ and TNF-α), TLR2 and p-NF-κB. NC, Normal control group; P, P. acnes treated group; P+Pla, P. acnes treated with placebo; P+clin, P. acnes treated with clindamycin; P+BV, P. acnes treated with bee venom.
적 요
천연물인 봉독은 다양한 질환에서 항염증 및 항균효과에 대하여 활발한 연구가 진행되고 있다. 그러나 대표적인 염증성 피부질환 중 하나인 여드름 발생 과정에서 봉독의 여드름 치료 효과 및 일반적 치료약물과의 효능 비교에 관한 연구는 미흡한 실정이다. 본 연구에서는 여드름 치료제로서의 봉독의 효능을 알아보기 위하여 대표적인 여드름 치료 약물인 클린다마이신 약제와의 효능을 비교하고자 하였다. 대표적인 여드름 유발 균주인 P. acnes를 마우스의 귀 피내에 투여 하여 염증성 피부질환 유도 동물모델을 확립하였고, 일반적으로 알려져 있는 여드름 치료약제인 클린다마이신(1%)을 도포하였을 때, P. acnes로 유도된 염증반응이 억제됨을 관찰하였다. 또한, 염증성 피부질환 동물모델에 봉독을 농도별로(50, 100, 200, 400μg/g)로 처리 하여 여드름의 주원인인 P. acnes에 대해 강한 항염증 효과가 있는 것을 육안적 평가로 관찰하였다. P. acnes로 유도된 염증성 피부질환에서 봉독과 클린다마이신의 효력을 비교하기 위하여 염증관련 사이토카인 및 전사인자인 NF-κB의 발현을 관찰하였다. P. acnes로 염증이 유도된 마우스의 귀 조직에서 염증성 사이토카인의 발현과 전사인자인 NF-κB의 활성이 정상 마우스보다 현저히 증가함을 관찰할 수 있었다. 그러나, 봉독(200μg/g)과 클린다마이신(1%)을 처리한 군에서는 염증관련 인자들의 발현이 현저히 감소함을 관찰하였으며 특히, 봉독의 효능은 시판약제인 클린다마이신의 효력과 거의 유사하거나 뛰어남을 관찰하였다. 따라서, 봉독은 여드름 유발균인 P. acnes의 활성과 염증반응을 억제시킴으로써 염증성 여드름 치료에 효과가 뛰어날 것으로 사료된다. 위의 결과를 토대로 천연물인 봉독을 활용하여 약리효과가 뛰어나며 부작용이 적은 여드름 치료제의 개발에 근거자료로 활용될 수 있을 것으로 사료된다.
Acknowledgments
본 논문은 농촌진흥청 연구사업(세부과제번호:PJ01132502)의 지원에 의해 이루어진 것임
References
- 김현주, 임혜원, 김보현, 김학수, 최신욱, 윤창순, (2006), 선학초 추출물의 항여드름균 효능 연구, J. Soc. Cosmet. Scientists Korea, 32, p53-58.
- 이우람, 박지현, 김경현, 안현진, 한상미, 박관규, (2011), 봉독이 여드름 균으로 유도된 염증성 동물모델에 미치는 효과, 생약학회지, 42(4), p366-370.
- 임미라, 강상모, (2009), 여드름 피부에 미치는 함초 식이의 피부 개선 효과, J. East Asian Soc. Dirtary Life, 19, p750-760.
- 박지현, 김경현, 한상미, 여주홍, 박관규, 이광길, (2007), 봉독이 간경화 동물 모델에 미치는 영향, 한국양봉학회지, 22(2), p173-179.
- 한상미, 이광길, 여주홍, 권해용, 이인경, 이명렬, 이만영, 백하주, 배기환, (2005), 전기충격법으로 채취한 국내산 봉독의 항균효과 (I), 한국양봉학회지, 20(1), p53-58.
- 한상미, 이광길, 여주홍, 김원태, 박관규, (2009), 국내산 봉독의 여드름 유발균 및 피부 상재균 증식 억제 효과, 생약학회지, 40(3), p173-177.
-
Boone, D., Lee, E., Libby, S., Gibson, P., Chien, M., Chan, F., Madonia, M., Burkett, P., Ma, A., (2002), Recent advances in understanding NF-κB regulation. Inflamm, Bowel. Dis, 8, p201-212.
[https://doi.org/10.1097/00054725-200205000-00008]

-
Burton, J. L., and S. Shuster, (1971), The relationship between seborrhea and acne vulgaris, Br. J. Dermatol, 84, p600-604.
[https://doi.org/10.1111/j.1365-2133.1971.tb02553.x]

-
Cunliffe, W. J., Holland, D. B., and Jeremy, A., (2004), Comedone formation: etiology, clinical presentation, and treatment, Clin. Dermatol, 22, p367-374.
[https://doi.org/10.1016/j.clindermatol.2004.03.011]

- Dunn, J. D., and J. J. Killion, (1998), Effect of mellitin on pituitary adrenal responsiveness to stress, Acta. Endocrinol, 119, p339-344.
-
Fisher, G., Datta, S., Talwar, H., Wang, Z., Varani, J., Kang, S., Voorhees, J., (1996), Molecular basis of sun-induced premature skin ageing and retinoid antagonism, Nature, 379, p335-339.
[https://doi.org/10.1038/379335a0]

- Freak, J., (2006), An overview of acne vulgaris, Nurs. Times, 102(30), p30-32.
-
Gollnick, H., Cunliffe, W., Berson, D., Dreno, B., Finlay, A., Leyden, J. J., Shalita, A. R., Thiboutot, D., (2003), Management of acne: a report from a global alliance to improve outcomes in acne, J. Am. Acad. Dermatol, 49(1 Suppl), pS1-S37.
[https://doi.org/10.1067/mjd.2003.618]

-
Habermann, E., (1971), Chemistry, pharmacology and toxicology of bee, wasp and hornet venoms, In Venomous Animals and their Venoms, 3, p61, Academic Press.
[https://doi.org/10.1016/B978-0-12-138903-1.50009-0]

-
Kang, S., Cho, S., Chung, J. H., Hammerberg, C., Fisher, G. J., Voorhees, J. J., (2005), Inflammation and extracellular matrix degradation mediated by activated transcription factors nuclear factor-κB and activator protein-1 in inflammatory acne lesions in vivo, Am. J. Path, 166(6), p1691-1699.
[https://doi.org/10.1016/S0002-9440(10)62479-0]

- Lim, Y. S., Myung, K. B., Chung, N. E., Chung, W. S., (1995), A study in the MIC of antibiotics for Propionibacterium acnes in patients with acne. Kor, J. Dermatol, 33, p437-444.
-
Nathan, C. F., (1987), Secretory products of macrophages, J. Clin. Invest, 79, p319-326.
[https://doi.org/10.1172/JCI112815]

- Salvemini, D., Korbut, R., Anggard, E., Vane, J., (1990), Imminediate release of a nitric oxide-like factor from bonine aortic endothelial cells, Proc. Natl. Acad. Sci, 87, p6007-6015.
-
Son, D. J., Lee, J. W., Lee, Y. H., Song, H. S., Lee, C. L., Hong, J. T., (2007), Therapeutic application of anti-arthritis, painreleasing, and anti-cancer effect of bee venom and its constituent compounds, Phaemacol. Ther, 115, p246-270.
[https://doi.org/10.1016/j.pharmthera.2007.04.004]

-
Taub, A. F., (2007), Procedural treatments for acne vulgaris, Dermatol. Surg, 33(9), p1005-1026.
[https://doi.org/10.1111/j.1524-4725.2007.33215.x]

-
Van de kerkhof, P. C., Kleinpenning, M. M., de Jong, E. M., van Dooren-Greebe, R. J., and Alkemade, H. A., (2006), Current and future treatment options for acne, J. dermatolog. Treat, 17(4), p198-204.
[https://doi.org/10.1080/09546630600830596]

- Vowels, B., Yang, S., Leyden, J., (1995), Induction of proinflammatory cytokines by a soluble factor of Propionibacterium acnes: implications for chronic inflammatory acne, Infect. Immun, 63, p3158-3165.
-
Webster, G., and J. Leyden, (1980), Characterization of serumindependent polymorphonuclear leukocyte chemotactic factors produced by Propionibacterium acnes, Inflammation, 4, p261-269.
[https://doi.org/10.1007/BF00915027]

- Whitney, K. M., and C. M. Ditre, (2011), Anti-Inflammatory Properties of Clindamycin: A Review of Its Use in the Treatment of Acne Vulgaris, Clinical Medicine Insights: Dermatology, 4, p27-41.
-
Yamamoto, Y., and R. Gaynor, (2001), Role of the NF-κB pathway in the pathogenesis of human disease states, Curr. Mol. Med, 1, p287-296.
[https://doi.org/10.2174/1566524013363816]
