국내 밀원별 주요 벌꿀의 품질 특성 및 평가
초록
국내 벌꿀 생산은 지난 30년간 비약적으로 증가하였다. 벌꿀의 품질 관리도 높은 수준으로 이루어지면서 국내생산 벌꿀에 대한 인지도 역시 높아졌다. 동시에 사양꿀을 합법화하면서 고품질 벌꿀 시장을 위협할 소지도 존재한다. 본 연구는 한국양봉협회에 분석 의뢰된 시료 중 일부를 선택하여, 벌꿀의 기본 규격과 안정동위원소분석법을 이용한 벌꿀 속 탄수화물의 기원을 평가하였다. 2014년 분석된 3796건의 표본 시료의 분석 결과, 수분함량 기준을 초과하는 시료는 아카시아꿀의 70%나 되었다. 전화당은 아카시아꿀이 가장 높았다. 아카시아꿀, 밤꿀, 잡화꿀의 과당은 평균 41.9, 41.9, 38.7%, 포도당은 28, 24, 28.8%이었으며 F/G값은 밤꿀이 1.75로 높았다. HMF는 대부분 기준 범위 이내이었으나 일부 시료는 200mg/kg 이상인 시료도 확인되었다. 탄소안정동위원소비가 -22‰ 이상인 것은 아카시아꿀의 6.7%, 잡화꿀의 9.95%이었다. 지속적인 벌꿀의 품질 특성 평가 및 개선이 지속적 양봉산업의 발전을 위해 요구된다.
Abstract
Honey production in Korea has increased significantly for the last few decades. Enforcement of the high standard for honey quality and its control would increase the public awareness of pure domestic honey. This study evaluated the quality of honey from different nectar origins of 2014. Among 3796 samples, 78.7% were acacia honey, 2.6% chestnut, and 18.7% were multifloral honey. 70% of acacia honey showed moisture contents higher than 20%. Inverted sugar content was highest in acacia honey. Fructose was 38~41% whereas glucose was 24~29% with higher F/G ratio from chestnut honey. Most honey samples showed lower (4~9mg/kg) HMF contents but some showed extreme high values above 200mg/kg. Stable carbon isotope ratio showed clear two peaks of frequency around -12 and -24 which indicates the possible adulteration of other carbohydrates from C4 plants. Sample above -22‰ was 6.7% of acacia honey, and 9.95% of multifloral honey. Continuous quality assessment and control is the vital element for the sustainable development of beekeeping industry.
Keywords:
Adultration, HMF, Inverted sugar, Codex, Stable carbon isotope ratio서 론
벌꿀은 꽃꿀 또는 식물이나 흡즙성 곤충의 분비물을 벌이 모아와서 꿀벌의 타액 등과 섞고, 탈수한 후 숙성할 수 있게 벌집에 저장한 자연 감미료로 정의되는 물질이다(Codex, 2001). 국내에서는 양봉꿀벌(Apis mellifera L.) 또는 재래꿀벌(Apis cerana)이 각종 식물의 꽃에서 꿀을 수집하여 전화시키고 저장한다. 따라서 벌꿀은 높은 농도의 전화당(포도당과 과당), 자당 및 기타 당류를 포함하는 탄수화물, 소량의 아미노산, 미네랄 그리고 각종 방향성 물질과 꽃가루, 효소, 비타민 등을 포함하게 된다. 벌꿀은 양봉가의 가장 중요한 수입원으로, 국내의 경우, 약 150~200만군 내외에서 25,000톤의 벌꿀이 생산된다(Jung and Cho, 2015). FAO에서 집계한 1993~2013년 사이의 평균자료를 보면(FAOSTAT, 2015), 세계적으로 약 7,300만군의 꿀벌이 약 160만톤 내외의 벌꿀을 생산하고 있다. 그 중 백만 군 내외의 양봉강국은 20여국에 이르며, 전체 벌꿀의 80%를 차지한다(Fig. 4). 물론 지역적 편차가 존재하고 있지만 꿀벌 봉군수와 벌꿀생산량은 꾸준히 증가하는 추세임은 분명하다(Aizen and Harder, 2009). 전체 생산의 25% 내외가 국제교역의 대상이 되며, 주 수입처는 EU, 미국, 일본 등으로 전체 교역량의 80%이상을 차지한다. 주요 수출국가는 중국, 아르헨티나, 멕시코, 인도 등이 되며, 소규모이지만 고가의 수출은 주로 뉴질랜드, 호주에서 이루어지고 있다(Ghosh and Jung, 2016, Fig. 4).
벌꿀은 원재료의 출처에 따라, 맛과 향, 물리화학적 특성에 차이를 보인다. 또한 벌꿀의 유래, 생산 과정은 물론 보관, 유통 과정에 따라 품질 특성이 달라질 수 있는 바, 식재료로써의 규격을 정하고 있다. 국제적으로는 국제식품규격(Codex, 2001), 국내에서는 식품의약품안전처의 식품공전(MFDS, 2013; KFDA, 2015, 2016)에다음과같이규정하고있다 “. 벌꿀류란 꿀벌들이 꽃꿀, 수액 등 자연물을 채집하여 벌집에 저장한 벌집꿀과 이것에서 채밀한 벌꿀로서 화분, 로얄젤리, 당류, 감미료 등 다른 식품이나 식품첨가물을 첨가하지 아니한 것”을 말한다. 또한 그 규격으로 수분 20%, 물불용물 0.5%, 산도 40meq/kg, 전화당 60%, 자당 7%, 히드록시메틸푸르푸랄(HMF) 80mg/kg를 한계치로 규정하고 있으며, 물론 타르색소, 인공감미료, 이성화당 등이 포함되어 있지 않아야 한다고 규정하고 있다. 그리고 그 검사방법은 국제분석회학기구의 기본방법을 준용한다(AOAC, 2001).
그간 국내에서 벌꿀의 품질 분석을 위한 기기이용법, 분석방법, 순수벌꿀의 판정법, 또는 밀원별 벌꿀의 특성 등에 관한 연구가 수행된 바 있다. 또한 복잡한 이화학적 벌꿀 품질 평가방법을 간소화하기 위하여 근적외선분광분석을 활용하기 위한 연구(Cho and Ha, 2002)나 벌꿀 내 주 성분인 탄수화물의 생성 원리를 응용하여 밀원의 기원을 확인할 수 있는 탄소동위원소비율 연구(Padovan et al., 2003) 등을 통해 이후 실험실내 표준기법으로 활용되고 있다. 그리고 벌꿀은 단당류를 포함하는 에너지원으로써의 가치도 높지만, 건강기능성 측면에서 소비자들의 관심을 받고 있다(Cha and Bang, 1999a,b; Weston, 2000; Gheldof et al., 2002; Traynor, 2008; Han et al., 2010). 본 연구는 2014년 국내에서 생산되어 사)한국양봉협회 양봉산물연구소(사)에 분석 의뢰한 시료를 대상으로, 국내 현장에서 생산되는 벌꿀의 품질 특성을 파악하고자 실시하였다.
재료 및 방법
시료 표본집단
전국의 양봉가들이 2014년 생산한 벌꿀 중 한국양봉협회 양봉산물연구소(사)에 의뢰해서 분석한 4800여 건 중 항목별 자료가 충실한 3796건을 대상으로 하였다. 표본 중 아카시아벌꿀은 78.7%(2987건), 밤꿀은 2.6%(97건), 잡화꿀은 18.7%(712건)이었다(Fig. 1).

Floral source distribution of honey samples used in this study which were collected and analyzed by BPI, KBA in 2014.
수분함량 수분함량 측정은 시료를 잘 섞고 20°C를 유지하면서 압베굴절기(NAR-1T, Atago, Tokyo, Japan)를 이용하여 굴절률을 측정하고 식품공전에 명시된 온도에 따른 보정 값을 적용한 후 수분환산표에 따라 수분함량을 산출하였다.
전화당과 자당 함량
벌꿀의 전화당 및 자당 함량은 식품공전의 액체크로마토그래피법에 따라 측정하였다(MFDS, 2013). 100mL의 메스플라스크에 시료 1g을 정밀히 달아 증류수 25mL로 넣어 녹이고, 아세토니트릴로 표선까지 정용한 후 0.45μm 멤브레인 필터로 여과하여 시험용액으로 사용하였다 . 기기는 Waters HPLC system(e2695, Waters, Milford, MA, USA)을 이용하여 분석하였다. 이때 HPLC 조건은 Prevail Carbohydrate ES(4.6×250mm, 5μm; Grace Davison Discovery Sciences, Deerfield, IL, USA) 컬럼을 사용하였고, 컬럼 온도는 40°C, 이동상은 아세토니트릴:증류수(75:25, v/v)를 사용하여 분당 1.0mL 속도로 유지시켰으며 주입량은 10μL로 하여 굴절계검출기(2414, Waters, Milford, MA, USA)를 사용하여 분석하였다. 표준용액은 glucose, fructose 및 sucrose(Sigma-Aldrich, St. Louis, MO, USA)를 사용하여 1%의 stock solution을 조제한 후 0.25, 0.5 및 1%의 농도로 희석하여 측정된 결과로부터 작성된 검량선을 이용하여 전화당 및 자당 함량을 계산하였다.
HMF (Hydroxymethylfurfural) 함량
벌꿀의 HMF 함량은 식품공전의 액체크로마토그래피법에 따라 측정하였다(MFDS, 2013). 50mL의 메스플라스크에 시료 5g을 정밀히 달아 증류수로 정용한 후 0.45μm 멤브레인 필터로 여과하여 시험용 액으로 사용하였다. 기기는 Waters HPLC system(e2695, Waters)을 이용하여 분석하였다. 이때 HPLC 조건은 Xbridge C18(4.6×250mm, 5μm, Waters, Dublin, Ireland) 컬럼을 사용하였고, 컬럼 온도는 40°C, 이동상은 메탄올:증류수(10:90, v/v)를 사용하여 분당 1.0mL 속도로 유지시켰으며 주입량은 20μL로 하여 UV/Vis 검출기(2489, Waters)를 사용하여 분석하였다. 표준용액은 HMF (Wako Chemical, Osaka, Japan)를 사용하여 100mg/L의 stock solution을 조제한 후 0.5, 1, 2.5, 5 및 10mg/L의 농도로 희석하여 측정된 결과로부터 작성된 검량선을 이용하여HMF 함량을 계산하였다.
탄소안정동위원소 비율
분석에 사용된 벌꿀의 순도 여부 확인을 위하여 AOAC(2001)에 등재된 벌꿀의 안정탄소동위원소비율 분석법을 활용하였다. 분석기기는 원소분석기(Elemental analyzer (EA), Vario micro cube, Elementar, Hanau, Germany)가 장착된 안정동위원소 질량 분석기(Isotope ratio mass spectrometer (IR-MS), Isoprime, Cheadle, UK)를 사용하였다. 안정탄소동위원소비율은 시료 약 150μg을 주석 캡슐에 넣어 세밀하게 밀봉한 후 원소분석기에 주입하였다. 이는 1150°C의 고온으로 유지된 원소분석기 상에서 산소 공급 하에 연소로와 환원로의 컬럼을 거쳐 완전연소시킨 후 흡착 컬럼에 의해 잔존하는 수분을 완전히 제거하여 얻어진 가스를 표준 기체(δ13C: CO2)와 함께 He을 운반 기체로 하여 안정동위원소질량 분석기에 주입되어 안정탄소동위원소 비율의 값을 자동으로 측정한다. 분석에 사용된 가스는 운반 기체로 헬륨(He, Donga Industrial Gas, Seoul, Korea), 표준 기체는 이산화탄소(CO2, Donga Industrial Gas)로 순도 99.999% 이상인 것을 사용하였다. 표준물질은 국제 원자력 기구(IAEA: International Atomic Energy Agency)에서 인증된 것으로 IAEA-CH-6 (Sucrose: -10.449±0.033‰ VPDB, IAEA, Vienna, Austria)을 사용하였다.
안정탄소동위원소비율 값은 relative delta per mil (d‰)을 단위로 하여 표준물질인 Vienna Pee Dee Belemnite (VPDB)의 안정탄소동위원소비율에 대한 시료의 안정탄소동위원소비율을 환산하여 다음 계산식에 의하여 산출하였다.
통계 분석
분석된 결과 자료들은 벌꿀의 종류별 특성을 비교하였으며, 국내 식품공전에서 제시된 기준과의 적합도를 평가하였다. 벌꿀의 종류별로 각 결과값의 평균과 그 분포는 분산분석법(ANOVA)으로 평가하였으며, 집단간 평균값의 차이여부는 최소자승법(Tukey’s LSD)을 통해 유의수준 0.05에서 결정하였다(SAS, 2013).
결과 및 고찰
수분함량
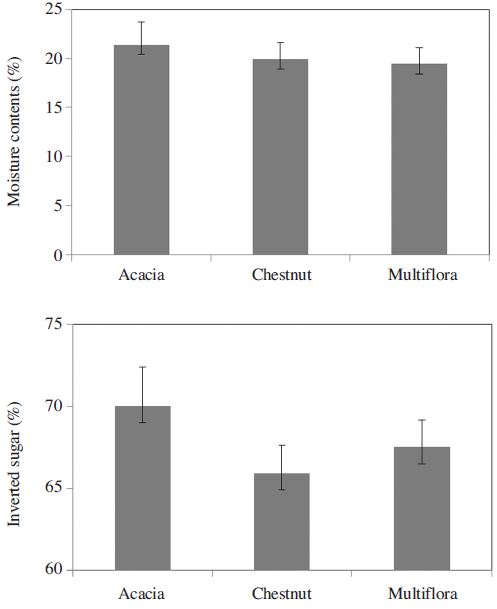
전체 조사된 시료의 평균 수분함량은 19.5±1.68(mean±SD)%이었으며, 아카시아벌꿀은 21.36±2.36%, 밤꿀이 19.91±1.689, 잡화꿀은 19.44±1.645로 밀원별로 뚜렷한 차이가 나타났다(Fig. 2; ANOVA, df=2,3793, F=224.4, P<0.001). 아카시아벌꿀이 가장 높은 수분 농도에서 수확되는 것으로 나타났고, 그 변이 계수는 11%이었다. 또한 식품공전상 판정기준인 수분함량 20%를 감안할 때, 아카시아벌꿀의 경우, 분석 의뢰한 시료의70%가 기준 함량을 초과하였다.
전화당 및 자당 함량
벌꿀의 주성분은 포도당과 과당인 데, 이 두 종류의 단당류는 꽃꿀의 주성분인 이당류인 자당에서 꿀벌의 타액에서 분비된 전화효소(invertase)에 의해 분해된 것으로 이를 전화당이라 하고, 식품공전에서는 꿀벌의 규격으로 전화당 60% 이상을 제시하고 있다. 조사된 시료들의 평균 전화당 비율은 67.5±3.5%이었으며, 아카시아꿀이 다른 꿀보다 전화당 비율이 더 높게 나타났다(ANOVA, df=2,3793, F=311.9, P<0.001). 밤꿀과 잡화꿀은 전화당 비율이 65~67%인 반면 아카시아꿀은 69.99±2.59%로 나타났다(Fig. 2). 조사된 시료 중 전화당이 60% 기준보다 낮게 나타난 시료는 아카시아꿀 중에서는 0.3%, 다른 종류의 벌꿀은 2~3%로 나타났다.
전화당의 구성을 보면 다음과 같다. 벌꿀 내 단당류인 과당과 포도당의 함량은 전체적으로 과당이 38.7±2.98%로 포도당 28.8±2.13%보다 높았으나, 벌꿀의 밀원 종류별로 조금씩 차이가 있었다. 아카시아꿀과 밤꿀은 과당 함량이 41% 내외이었으나 잡화꿀은 38.7%로 조금 낮게 나타났다. 반면 포도당은 아카시아꿀과 잡화꿀은 28% 내외, 밤꿀은 24%대로 낮게 나타났다. 이에 따라 과당/포도당 비율은 각 1.49, 1.34 그리고 1.75로 나타났다. 벌꿀 내 자당의 농도는 전반적으로 2.5% 대에서 유지되었다(Table 1). 그러나 일부 시료에서 그 함량이 29.2%인 것도 있었다. 이러한 극한값은 아카시아꿀에서 과당과 포도당 함량에서도 나타난다. 두 당류의 함량이 각 20% 이하인 값들도 분포한다(Table 1).

Contents (%, mean±SD) of major carbohydrates of honey; fructose, glucose and sucrose from honey samples of different floral sources collected in 2014. Values within the parenthesis are the minimum and maximum
HMF 함량
벌꿀의 HMF는 갈변의 주요 원인이 되면서, 벌꿀에 가해진 열에 대한 흔적을 지표한다. 산성의 벌꿀에서 과당 등 5탄당이 포도당 등 6탄당의 탈수 반응에 의해 생성되는 데 주로 장기간의 보관 및 열 변화 등에 의해 가속고, 설탕 등의 인위적 혼입으로 인해서도 증가한다(Kim et al., 2014). 아카시아꿀과 밤꿀은 평균 4.7~4.9범위였으며, 잡화꿀은 평균은 7.4였으나, 표준편차가 평균의 2배 이상으로, 변이계수가 216%로 나타났다. 즉 잡화꿀의 경우 열 스트레스를 많이 받거나 또는 장기간 보관되고 있을 수 있으며, 경우에 따라서는 이미 열가공이 이루어진 설탕 등이 혼입되었을 가능성도 있겠다. 밤꿀의 경우 색깔은 짙은 갈색이지만 HMF 값은 그리 높지 않았다. 갈색의 밤꿀에는 높은 수준의 항산화 및 항생성을 가지는 플라보노이드 등 페놀류를 함유한다(Lee et al., 2007).
탄소안정동위원소 비율
현재까지 가장 안정적으로 벌꿀의 순도를 지표할 수 있는 방안으로 탄소안정동위원소비율 측정법을 지목하고 있다. 본 연구에서 조사한 3796개의 시료에서 측정된 탄소안정동위원소비율(-‰)은 벌꿀 밀원별로 유의한 차이를 보였다(Table 3). 아카시아꿀과 잡화꿀은 평균 23 내외이었으며, 표준편차가 2.6~2.7 정도로 변이계수가 10%대로 나타난 반면 밤꿀은 24.38±0.537로 변이계수가 2%대로 매우 균일한 탄소안정동위원소비 분포를 보였다(Table 3, Fig. 3). 반면 아카시아꿀과 잡화꿀에서는 그 당의 유래가 뚜렷하게 구분되었다.

ANOVA statistics of stable carbon isotope ratio (δ13C, ‰) of honey samples of different floral sources collected in 2014

Frequency distribution of stable carbon isotope ratio (- δ13C, ‰) of honey samples by different floral sources collected in 2014.
탄소안정동위원소비율 분석법은 생물체 내의 탄소대사경로가 달라짐으로 인해서 안정동위원소인 C13의 C12에 대한 상대적 비율이 달라진다는 사실에 기초한다. 특히 식물의 경우 광합성을 통한 탄수화물 합성 경로는 칼빈회로를 경유하는 C3식물군과 HS 사이클을 경유하는 C4식물군으로 크게 나뉜다. 옥수수, 사탕수수 등 C4식물군의 탄수화물은 -(9~14)‰ 정도의 안정동위원소비를 가지는 반면, 대부분의 C3식물들은 22~27‰ 값을 가진다. 사탕수수에서 추출한 자당(설탕)이나 옥수수에서 추출한 당의 경우 -(12~14)‰을 보이는 데, Fig. 3에서 보면, 아카시아꿀과 잡화꿀에서 상당 비율의 C4 기원의 당 흔적을 볼 수 있다. 현재 국내에서 벌꿀의 기준으로 고려하고 있는 탄소 안정동위원소비 -22‰를 기준으로 볼 때, 아카시아꿀 6.7%, 잡화꿀 9.95%가 이 기준을 충족시키지 못하고 있음을 볼 수 있다. 또한 1+등급 기준인 23.5를 기준으로 본다면 밤꿀은 95.9%, 아카시아꿀은 89.6%, 잡화꿀은 85.9%가 이 기준을 충족하는 것으로 나타났다.
벌꿀 품질 관리 중요성
지난 30여년간 국내 벌꿀 생산은 비약적으로 증가하였다(Jung and Cho, 2015). 국내 벌꿀 시장은 이미 포화 단계에 다다르고 있으며, 고가와 저가의 외국산 벌꿀이 국내로 수입되고 있다. 향후 한-베트남 FTA 등 다양한 자유무역체계에서 외국산 벌꿀 등의 수입 요구는 점점 거세질 것으로 전망한다. 전세계의 주요 양봉 강국들이 아시아, 아프리카, 남미 등에 분포하고 있으며(Fig. 4), 우리나라 양봉 산업은 전적으로 내수에 의존하고 있으며, 수출 물량은 극히 저조한 실정에서, 고품질 벌꿀 생산의 요구는 더욱 증가할 것이며, 이에 따른 적절한 품질관리가 요구된다. 국내 생산 벌꿀에 대한 다양한 분석 연구가 보고된 바 있다. 벌꿀 속 꽃가루 분석(Lee et al., 1992; Woo et al., 1999; Ryu, 2004), 단일 벌꿀의 화학적 특성(Woo and Kim, 1999; Paik et al., 2013, 2014, 2015)은 물론 다양한 생리기능성에 대한 관심(Cha and Bang, 1999a,b; Han et al., 2010)이 양봉학 저변에서 지속되었으나. 벌꿀의 핵심 특성 분석은 주로 식품공학적 측면에서 다루어졌다(예, Kim et al., 2014).
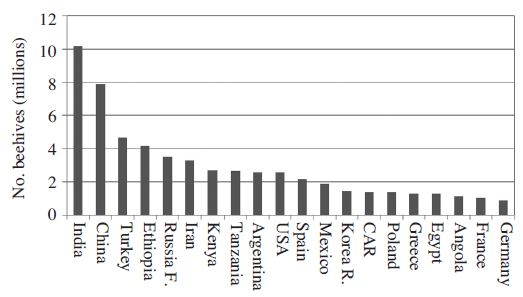
Honeybee hive number distribution of the leading apicultural countries (Data from FAOSTAT, average of 1993-2013).
양봉산업의 지속적 발전을 위해서 벌꿀 원료의 기원의 명시성은 중요하다. 국내외 벌꿀의 규격 및 기준에도 식물의 꽃, 또는 흡즙성 곤충의 흡즙 후 분비물을 수집한 후, 분비물질을 이용하여 변환하고 탈수하고 벌집에 넣어서 숙성시킨 자연감미물질로 규정하고 있기 때문이다(Codex standard 12-1981, 2001). 또한 국내법으로도 벌꿀은 다음과 같이 규정된다. 최근 농수축산신문(2015.04.21)에 따르면, 축산물품질평가원은 탄소동위원소비 23.5‰와 수분함량 20%, 25% 기준을 제시하였으며, 한국양봉협회 역시 이와 비슷한 기준을 제시하였다. 특히 눈 여겨 볼 부분은 최근 식약처 고시(2016-43호)의 순수벌꿀과 사양벌꿀을 구분하는 자율표시제도이다. 그런데 사양벌꿀을 “꿀벌의 생존을 위해 최소량의 설탕으로 사양한 후 채밀한 벌꿀”이라고 규정한 부분이다(KFDA, 2016). 전세계적으로 벌꿀의 진위 여부는 논란의 대상이다. 다양한 시럽 및 설탕 등이 꿀벌의 먹이로, 벌꿀에 혼합되기 때문이다. 이에 혼합꿀을 가려내기 위한 최초의 성과는 탄소안정동위원소분석법(Stable carbon isotope ratio analysis: SCIRA)을 이용하여 HFCS나 사탕수수 등에서 뽑아낸 설탕을 구분해 낼 수 있음을 밝혀(Donner et al., 1979Ziegler et al., 1979; White et al., 1998), AOAC(2001)에서 벌꿀에서 C4 설탕을 구별해 내는 공식 방법으로 채택되었다. 이는 벌꿀에 가장 많은 원소가 탄소이며, 탄소는 12의 원자량을 가지고 있지만(98.89%), 원자량이 13인 동위원소도 1.11% 가량 존재한다. 물론 탄소 중 원자량이 10, 11, 14 등도 존재하나, 이들은 안정되지 않기 때문에 방사성동위원소라 하여, 반감기를 이용한 연대추정 등에 많이 이용된다. 반면, 원자량 12와 13인 탄소동위원소는 안정된 상태로 존재하기 때문에 자연계에서 더 생기거나 없어지지 않는다. 그러나 이 비율은 탄소가 생물체 내외를 드나들면서 일시적 조성비가 달라질 수 있다. 그래서 국제표준시료(PDB)에서13C/12C의 비율을 정해 놓았는 데, 이의 차이를 δ13C값으로 표현한다 AOAC(2001). 즉 -23‰이라면, 국제표준시료보다 23‰(2.3%) 적다고 보면 된다. 벌꿀의 주원료인 꽃꿀도 자당(sucrose)이 대부분이다. 사탕수수, 사탕무, 옥수수 시럽 등에서 뽑아내는 설탕도 주성분이 자당(sucrose)이다. 그렇다면 이 두 계열의 자당을 어떻게 구분할 수 있을까? 여기서 식물의 당 합성 경로를 살펴 보아야 한다. 설탕을 생산하는 사탕수수, 옥수수 등은 C4 cycle을 이용한 광합성을 통해 당을 생산하고, 이당의 δ13C값(탄소 동위원소 값)이 -10에서 -20‰인데 반하여, 주요 밀원에서 생산되는 당은 C3 cycle을 통해 당을 생산하고, δ13C값은 대개 -23에서 -27‰ 정도로 분포한다는 사실에 기인한 분석법이다. 이를 기반으로 탄소안정동위원소비율 분석법이 개발된 것이다.
미국에서 분석한 119개의 순수벌꿀 샘플에서 측정된 δ13C 값은 평균 -25.4‰(범위는 -22.5 ~ -27.4‰, 표준편차 0.98)이었다. 규제를 위한 순수벌꿀의 기준을 표준편자의 4배로 정할 경우, 판정 오류의 확률은 0.001%로 줄어드나 최저점인 -21.5‰(-25.4+0.98×4)는 C4 설탕의 20% 혼합을 의미하게 된다. 이러한 이유로 인해 미국양봉협회에서는 TLC(thin layer Chromatography)를 통한 추가 분석을 통해 2배 표준편차에 해당하는 -23.5‰ 기준을 추가하였다. 1978년 미국양봉협회(ABF)에서는 TLC와 Hydroxymethylfurfural(HMF) 분석을 통해 벌꿀을 분석하고 의심되는 시료만을 추가적으로 SCIRA하였다. 1979년부터 6년에 걸친 분석 시료에서 약 20% 정도가 불합격 판정을 받았다. 이후 식물의 종류에 따라서 δ13C값이 달라질 수 있다는 가설이 제기되고, 귤(citrus), CAM(Crassulacean acid metabolism) 식물(선인장 등의 다육식물) 등도 δ13C 값이 매우 낮음(-12 ~ 18)이 밝혀졌다(Ziegler et al., 1979).
좀 더 정확한 판정을 위하여 내부기준 탄소안정동위원소분석법(Internal standard SCIRA)이 개발되었는데 이는 순수벌꿀의 평균 안정동위원소 값 대신 벌꿀에서 추출해낸 단백질을 내부 기준으로 삼는 것이다. 이 근거는 다음과 같다. 동물 또는 동물의 생산물의 δ13C값은 전적으로 먹이에 의해 결정된다. 꿀벌은 꽃꿀/벌꿀과 꽃가루를 먹는다. 벌꿀에 존재하는 단백질은 거의 대부분 꽃꿀을 전화, 숙성하기 위해 꿀벌이 분비한 효소들이다. 따라서 벌꿀 속 단백질과 꿀벌은 비슷한 δ13C를 가질 것이다. 벌집에서 꿀을 추출한 후에 C4 당류를 섞으면, 혼합꿀의 δ13C 값은 변하지만, 단백질의 δ13C값은 변하지 않는다. 따라서 ISCIRA 지수(δ13C 단백질~δ13C 벌꿀)가 양수이면 C4 당류가 포함되지않았다고볼수있고, 음수이면 포함됐다고 할 수 있다. 이때 양수인 값을 제외하고 음수인 값을 negative difference로 정의한다. 이렇게 해서 1.0‰의 차이는 약 7%의 설탕혼입과 대응된다. 이 방법은 1992년에 공식적으로 인정되었고(AOAC method 991.41; White et al., 1998에서 인용) 다양한 지역에서 검증되고 향상되었다(Cotte et al., 2007; Yoo et al., 2010). 이 방법을 이용했을 때 가장 큰 장점은 같은 기계를 이용한 두 변수 측정치의 차이를 보는 것이기 때문에 실험실적오류, 기계나 과정 상에 발생하는 오류를 제거하기가 용이하다는 점이다. 이 새로운 방법을 통해 지난 90년대 중국에서 미국, 독일, 영국, 캐다나 등지로 수출된 303건의 벌꿀 분석 결과, 23.5‰ 이상이면서도 ISCIRA 기준을 추가했을 때, 약13%가 불량으로 판정이 되었으며, 18~23.4 사이의 벌꿀은 80.3%가 불량으로 판정되었다(White et al., 1998). 따라서 δ13C값 23.5‰ 이하 1978년대의 기준임이 분명하다. 즉, 벌꿀에 설탕 등을 혼합하여 δ13C값이 -23.5‰까지만 맞춘다면 불량 꿀을 구분해 낼 수 없다는 점이다. 이에 ISCIRA index 1.0‰을 추가되었다. Codex 기준에도 벌꿀 순도 분석 표준 방법으로 ISCIRA 를 채택하였다. 이 방법을 통해 벌꿀에 C4 당류(사탕수수나 옥수수 시럽 등)의 혼입은 밝혀낼 수 있으나, C3 식물 유래의 당(예, 사탕무)은 구분해 낼 수 없다. 또 한가지 단점은, 벌꿀 속에 혼재한 단백질을 분석하는 방법인 데, 단백질 함량이 매우 적다는 점이다. 벌꿀 100g 속에 단백질은 대개 58~86mg 밖에 존재하지 않기 때문에 객관적 시료 확보가 어렵다.
Giraudon et al.(2000)은 Deuterium NMR을 이용하여 SCIRA, MS 등의 자료를 보충할 수 있는 근거를 마련했다. 기본적으로 벌꿀을 발효하여 만들어낸 에탄올에서 동위원소 구성을 살펴보는 것으로, 이를 이용하면 당 유래 식물을 구분할 수 있다는 점이다. 이를 좀 더 개선하여 Cotte et al.(2007)은 단일 밀원에서 생산된 벌꿀을 비교 분석한 결과 대부분의 단일 밀원 벌꿀은 δ13C 25‰ 내외로 나타났다. 따라서 본 방법을 통하면 C3 식물에서 생산된 당의 혼입 등도 보다 효과적으로 검출할 수 있겠다. 지속적인 벌꿀 품질의 분석, 개선 노력이 양봉 산업의 지속적 발전을 위해 필요하다.
Acknowledgments
본 연구는 농촌진흥청 아젠다 PJ01048701 과제의 일부 지원을 받았기에 감사드립니다.
References
-
Aizen, M.A., and L.D. Harder, (2009), The global stock of domesticated honey bees is growing slower than agricultural demand for pollination, Curr. Biol, 19, p915-918.
[https://doi.org/10.1016/j.cub.2009.03.071]

- Cha, Y.H., and K.S. Bang, (1999a), Studies on the antibacterial activity of honey I. Antibacterial activity of black locust honey, Korean J. Apiculture, 14, p85-96.
- Cha, Y.H., and K.S. Bang, (1999b), Studies on the antibacterial activity of honey II. Antibacterial activity of chestnut honey, Korean J. Apiculture, 14, p97-104.
- Cho, H.J., and Y.L. Ha, (2002), Determination of honey quality by near infrared spectroscopy, Korean J. Food Sci. Tech, 34, p356-360.
- Codex, A.C., (2001), CODEX Standard for Honey, FAO/WHO Food Standard Programme, Rome, Italy.
- Codex, S. 12-1981, Codex for honey, (2001ed).
-
Cotte, J.F., H. Casabianca, J. Lheritier, C. Perrucchietti, C. Sanglar, H. Waton, and M. F. Grenier-Loustalot, (2007), Study and validation of 13C stable carbon isotopic ratio analysis by mass spectrometery and 2H site-specific natural isotopic fractionation by nuclear magnetic resonnance isotopic measurements to characterize and control the authenticity of honey, Analytica Chimica Acta, 582, p125-136.
[https://doi.org/10.1016/j.aca.2006.08.039]

- Doner, L. W., D. Chia, and J. W. White, (1979), Mass spectrometric13C/12C determination to disting uish honey and C3 plant syrups from C4 plant syrups (sugar cane and corn) in candied pine apple and papaya, J. Assoc. Off. Anal. Chem, 62, p928-930.
-
Gheldof, N., X.H. Wang, and N.J. Engeseth, (2002), Identification and quantification of antioxidant components of honeys from various floral sources, Journal of Agricultural and Food Chemistry, 50, p5870-5877.
[https://doi.org/10.1021/jf0256135]

-
Ghosh, S., and C. Jung, (2016), Global honeybee colony trend is positively related to crop yields of medium pollination dependence, Korean J. Apiculture, 31, p85-95.
[https://doi.org/10.17519/apiculture.2016.04.31.1.85]

- Giraudon, S., M. Danzart, and M.H. Merle, (2000), Deuterium nuclear magnetic resonance spectroscopy and stable carbon isotope ratio analysis/mass spectrometry of certain monofloral honeys, J. AOAC International, 83, p1401-1409.
- Han, S.M., K.G. Lee, J.H. Yeo, S.O. Woo, H.Y. Kweon, S.H. Nam, Y.Y. Jo, and W.T. Kim, (2010), Whitening effect of honey from Korea, Korean J. Apiculture, 25, p39-43.
-
Jung, C., and S.K. Cho, (2015), Relationship between honeybee population and honey production in Korea: A historical trend analysis, Korean J. Apiculture, 30, p7-12.
[https://doi.org/10.17519/apiculture.2015.04.30.1.7]

- KFDA, (2015), (2016), Korean Food and Drug Administration, Seoul.
-
Kim, J.Y., H.Y. Song, J.A. Moon, M.H. Shin, and S.H. Baek, (2014), Quality properties of honey in Korean commercial markets, Kor. J. Food Sci. Tech, 8, p432-437.
[https://doi.org/10.9721/KJFST.2014.46.4.432]

- Lee, M.L., H.K. Kim, M.Y. Lee, Y.S. Choi, H.B. Kim, H.G. Chung, and S.H. Kim, (2007), Antioxidant and antibacterial capacity of chestnut (Castanea crenata var. dulcis) honey produced in Korea, Korean J. Apiculture, 22, p147-152.
- Lee, S.T., S.W. Park, and J.G. Kim, (1992), Pollen analysis of five Korean honeys, Korean J. Apiculture, 7, p67-77.
- MFDS, (2013), Food Code. Not. 2013-2014, Ministry of Food and Drug Safety, Cheongju, Korea.
-
Padovan, G.J., J.D. De, L.P. Rodrigues, and J.S. Marchini, (2003), Detection of adulteration of commercial honey samples by the 13C/12C isotopic ratio, Food Chem, 82, p633-636.
[https://doi.org/10.1016/S0308-8146(02)00504-6]

- Paik, W.K., A.K. K, M.L. Lee, and H.S. Sim, (2014), Studies on the chemical characteristics of jujube (Zizyphus jujube var. inermis) and snowbell (Styrax japonica) honey produced in Korea, Korean J. Apiculture, 29, p125-135.
-
Paik, W.K., A.K. Kwak, M.L. Lee, and H.S. Sim, (2015), Studies on chemical characteristics of hovenia (Hovenia dulcis) honey produced in Korea, Korean J. Apiculture, 30, p75-85.
[https://doi.org/10.17519/apiculture.2015.06.30.2.75]

- Paik, W.K., A.K. Kwak, Y.J. Oh, M.L. Lee, and H.S. Sim, (2013), Studies on the chemical characteristics of hairy vetch (Vicia villosa Roth) honey produced in Korea, Korean J. Apiculture, 28, p345-354.
- Ryu, J.B., (2004), Pollen analysis in honey harvested from tree honey plants in Korea, Korean J. Apiculture, 19, p1-10.
- SAS, Institute, (2013), SAS/STAT user’s guide: Statistics, version 9.3, SAS Institute, Cary, NC.
- Traynor, K.S., (2008), Sweet solutions for good health, American Bee Journal, 148, p205-208.
-
Weston, R.J., (2000), The contribution of catalase and other natural products to the antibacterial activity of honey: A review, Food Chemistry, 71, p235-239.
[https://doi.org/10.1016/S0308-8146(00)00162-X]

- White, J.W., K. Winter, P. Martin, and A. Rossmann, (1998), Stable carbon isotope ratio analysis of honey: Validation of internal standard procedure for worldwide application, J. AOAC Internationa l, 81, p610-619.
- Woo, K.S., and H.Y. Kim, (1999), Pollen analysis of black locust honey and chestnut honey produced in Korea, Korean J. Apiculture, 14, p79-84.
- Woo, K.S., M.L. Lee, K.S. Cho, and Y.H. Cho, (1994), Quality analyses on some sorts of Korean honey with strategies for their qualities improvement, Korean J. Apiculture, 9, p144-167.
- Yoo, E.C., Y.K. Kong, and B.S. Yoon, (2010), A study on the improved analysis-methods to determine adulterated honeys, Korean J. Apiculture, 25, p63-76.
- Yoon, E.Y., S.S. Lee, and Y.K. Kim, (2001), Utilization of multiple-story hives for high production of honey in the spring season, Korean J. Apiculture, 16, p55-60.
-
Ziegler, H., U. Luttge, and W. Stichler, (1979), δ13C and δD values in the organic material of some nectars, Naturwissenschaften, 66, p580-581.
[https://doi.org/10.1007/BF00368821]