동충하초 폐배지 추출물을 이용한 Paenibacillus larvae 항균활성 검정
Abstract
American foulbrood (AFB) is the most serious and dangerous bacterial disease of honeybee brood caused by the spore forming bacterium Paenibacillus larvae. The aim of the present work was to evaluate the antimicrobial effect of a waste product of Cordyceps militaris extract against P. larvae and its potential for the control of AFB. For the test, the waste product of C. militaris was extracted with methanol and partitioned. And then, the fractions were tested for antimicrobial activity against P. larvae by the radial diffusion assay. The result showed that the portions of the ethyl acetate, and water-saturated n-butanol presented inhibitory capacity against strains of P. larvae, whereas the portions of n-hexane and chloroform were presented no inhibitory capacity against P. larvae. One way ANOVA tests for radial diffusion assay data, indicated significant differences. The results demonstrated that waste product of C. militaris possess beneficial properties for honey bee health and this property could be attributed to the kind and percentage of the main components of waste product of C. militaris portions.
Keywords:
American foulbrood (AFB), Paenibacillus larvae, Cordyceps militaris서 론
꿀벌은 벌꿀, 프로폴리스, 로얄젤리, 봉독, 화분, 밀랍 등 다양한 양봉산물을 생산하는 산업화된 산업곤충 중 하나이다. 최근 통계결과에 따르면 우리나라 2014년 벌꿀 생산액은 2천 4백억 원 수준으로(한국양봉협회, 2015), 축산업 생산액(18조원)의 1.3%의 비중을 차지하고 있으며, 약 2만 농가가 양봉업에 종사하고 있는 것으로 확인되고 있다. 그러나 최근 꿀벌은 전 세계적으로 질병(Bakonyi et al., 2002; Bailey, 1975; Bailey and Ball, 1991), 환경오염, 농약피해, 기후변화 등으로 인해 개체 수 감소가 가속화되고 있어(Watanabe, 2008; Ho and Cummins, 2007), 이에 대한 대책이 시급한 상황이다.
지금까지 알려져 있는 꿀벌의 주요 질병은 크게 감염성 질병과 기생성 질병으로 나눌 수 있다. 감염성 질병은 다시 세균성과 바이러스성, 진균성, 원생동물성 질병으로 나뉘는데, 그중 꿀벌 부저병은 세균성 질병으로, 그 원인균에 의해 다시 미국부저병(American foulbrood, AFB)과 유럽부저병(European foulbrood, EFB)으로 나뉜다. 미국부저병은 Paenibacillus larvae에 의해 꿀벌 유충에 병징을 일으키는 유충질병으로, White(1906)에 의해 처음 확인되었다. 이는 꿀벌에 발생하는 세균성 질병 중 가장 심각하고 위험한 것으로(Genersch et al., 2006), P. larva 포자가 함유되어있는 꿀, 화분 등의 먹이를 섭취함으로써 감염을 일으킨다. 미국부저병의 위험성은 P. larva로부터 생성되는 내생포자로부터 비롯된다. 이 병원체의 내생포자는 열등에 강한 내성을 지니고 있어 꿀이나 토양 등에 수년 내지 수 십년간 잔류 할 뿐만 아니라 높은 전염성을 지니고 있어 양봉장 전역에 빠르게 감염을 일으켜 큰 피해를 입게 되는 것을 특징으로 한다(Matheson and Reid, 1992).
미국부저병의 예방과 치료는 주로 옥시테트라사이클린(oxytetracycline hydrochloride, OTC) 이나 설파티아졸(sulfathiazole)과 같은 항생제 사용을 통해 이루어진다. 그러나 이러한 항생물질의 광범위한 사용은 벌꿀 및 기타 양봉산물 내 항생제 잔류 문제를 야기 시킬 뿐만 아니라, 항생제 내성균을 발생시켜(Kochansky et al., 2001; Piccini and Zunino, 2001) 유럽 대부분의 국가에서는 항생제 사용을 금지하고 있다. 이에 대한 대책으로 최근에는 AFB 저항성 꿀벌 계통의 육성(Wedenig et al., 2003), 길항 미생물(Evans and Armstrong, 2006) 및 천연항생물질 개발(Antunez et al., 2008; Fuselli et al., 2008) 등과 같이 AFB에 대한 항생제 사용을 억제하기 위한 다양한 연구개발이 이루어지고 있는 실정이다.
동충하초는 살아있는 곤충을 기주로 살아가는 곤충 기생균으로, 다양한 생리활성 물질을 함유하고 있다(Gu et al., 2007). 동충하초는 지금까지 약 800여 종이 분리·동정되어 왔으나 우리나라 식품공전 상 식품에 사용할 수 있는 원료로 분리되어 있는 것은 눈꽃 동충하초(Paecilomyces japonica / P. tenuipes)와 밀리타리스 동충하초(Cordyceps militaris) 두 가지 뿐이다. 그 중 밀리타리스 동충하초는 간기능 개선, 항암, 항염증 등 다양한 임상에 효과가 있으며(김 등, 2012; 조 등, 2008; 최 등, 2012; Park et al., 2005; Kim et al., 2008; Han et al., 2010), 코디세핀(cordycepin), 다당류(polysaccharides), 에르고스테롤(ergosterol), 만니톨(mannitol) 등의 주요 성분을 포함 하고 있는 것으로 알려져 있다(Das et al., 2010). 특히 동충하초는 다양한 균주에 대한 높은 항균 활성을 지니고 있다. 최근 Reis 등(2013)에 의한 연구결과에 따르면 밀리타스 동충하초는 그람 음성균 및 양성균 모두에 대해 높은 항균활성을 지니고 있으며, Ahn 등(2000)은 밀리타리스 동충하초의 주요 성분인 코디세핀(cordycepin)이 그람 양성균인 Clostridium paraputrificum에 대해 강력한 항균효과가 있다고 밝힌 바가 있다. 그러나 동충하초는 이처럼 다양한 생리활성 특성을 보유하고 있음에도 불구하고, 고가라는 비용적 한계 때문에 천연물 약제로서의 광범위한 적용에는 어려움을 겪고 있다. 따라서본연구에서는 이러한 한계를 극복하고자 동충하초의 자실체 부분을 제외한 폐배지 부분을 꿀벌 질병 방제에 이용하고자 하였다.
재료 및 방법
공시균주
본 실험에 사용된 균주는 Paenibacillus larvae(KACC 11540)로 한국농업유전자원센터(KACC)로부터 분양받았으며, MYPGP 배지를 사용해 배양하였다. 배지조성은 1L 당 10g Mueller-Hinton broth(Oxoid CM0405)와 15g yeast extract 및 3g K2HPO4, 1g Na-pyruvate를 첨가한 배지로, 멸균 후 최종적으로 20ml 10% glucose(autoclaved separately)를 첨가하여 사용하였다. 실험 전 -70°C에 보관된 균주 stock을 백금이로 MYPGP agar에 접종하여, 37°C에서 24시간 배양하였으며, 동일한 방법으로 MYPGP에서 적어도 3번 이상의 연속 배양을 거친 정지기 균을 실험에 사용하였다.
시료 및 추출물 조제
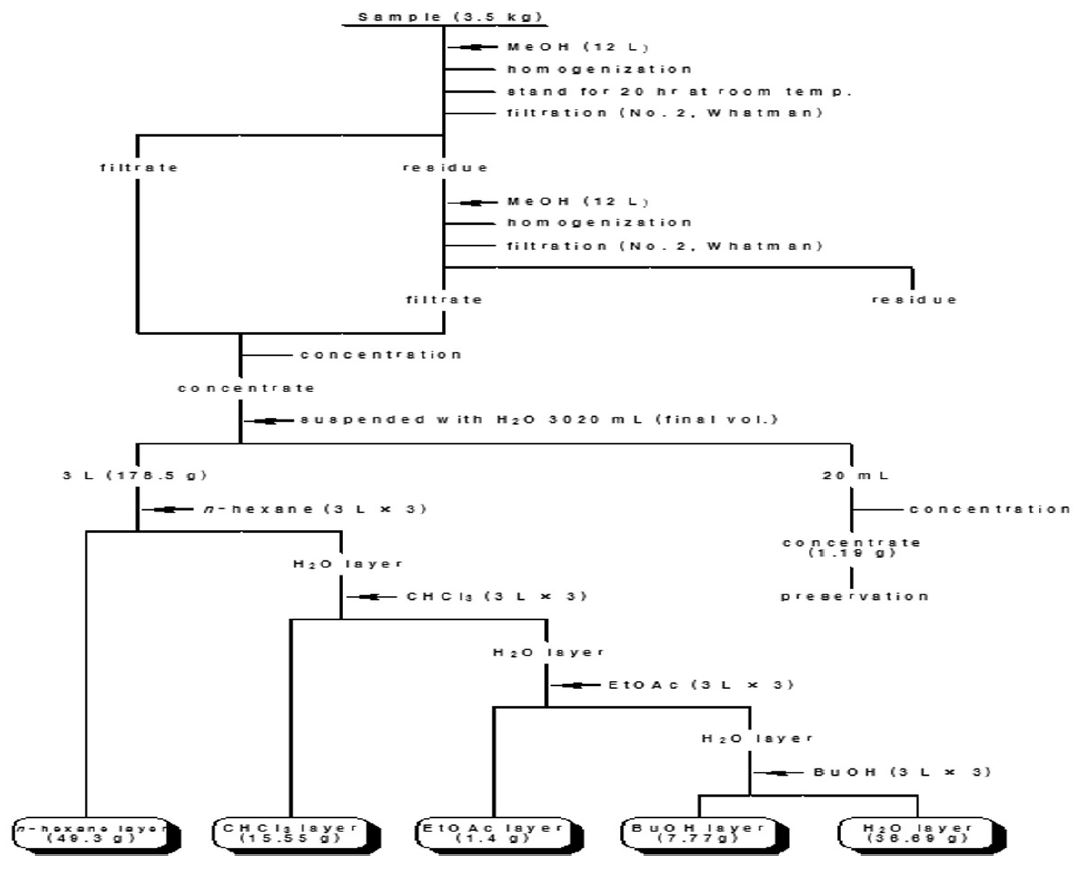
본 연구에 사용된 시료는 동충하초 재배 농가(예당버섯)로부터 구매하였으며, 현미동충하초 자실체 부분을 제외한 배지부분을 이용하였다. 동충하초 폐배지 분말 3.5kg에 MeOH 12L를 가해 잘 혼합하여 20시간 동안 정치시킨 후 상층액은 흡입여과(No. 2, Whatman)를 하고, 하층액은 MeOH 12L를 가해 교반한 후 재차 여과하였다. 얻어진 여액은 진공 농축기를 이용하여 농축하여 추출물 178.5g을 얻었다. 그 추출물을 H2O로 용해하여 3L로 정용하여 본 실험의 시료로 사용하였다.
동충하초 폐배지 추출물의 용매분획 및 TLC 분석
동충하초 폐배지 추출물(178.5g)의 H2O 현탁액(3L, 동충하초 배지 분말 3.5kg wet wt. eq.)에 n-hexane(3L×3), chloroform(3L×3), ethyl acetate(3L×3), 수포화 BuOH(3L×3)를 순차적으로 용매 분획하였다(Fig. 1). 얻어진 각 획분들은 감압 농축한 후 무게를 측정한 다음 CHCl3/EtOAc/AcOH/MeOH(9:1:0.1:0.1, v/v/v/v)와 BuOH/AcOH/H2O=4:1:1(v/v/v) 전개용매를 이용해 TLC chromatography를 실시하였다(Silica gel 60 F254, 0.25mm thickness, Merck, Darmstadt, Germany). 전개된 TLC plate 발색은 cerium sulfate hydrate를 사용하였으며, 항산화 활성 물질의 존재 여부를 평가하기 위해 1,1-diphenyl-2-picrylhydrazyl(DPPH) ethanol 용액(200μM)을 TLC plate에 분무하여 발색시켜 탈색되는지 여부를 확인하였다(Fig. 2, 3).
Radial diffusion assay에 의한 항균활성 검증
시험균주 P. larvae에 대한 동충하초 폐배지 용매 분획물의 항균활성 효과를 검증하기 위해 Lehrer 등(1991)의 방법을 변형한 radial diffusion assay를 실시하였다. 먼저, -70°C에 보관중인 P. larvae 균주를 MYPGP 배지 50ml에 접종한 후 35°C에서 24시간 200 rpm으로 진탕 배양하였다. 이후 새로운 MYPGP 배지 50ml에 배양액 50μl를 접종하고 35°C, 2.5시간 진탕 배양한 후, 4°C, 3000 rpm에서 10 분간 원심 분리하였다. 원심 분리한 침전물은 차갑게 보관된 10ml의 10mM sodium phosphate buffer(SPB, pH 7.4)로 2번 세척한 후 최종적으로 5ml SPB에 resuspension 하였다 . resuspension 용액은 620nm에서 흡광도를 측정한 후 4×106 CFU 를 항온수조(42°C)에 보관되어 있는 underlay agar에 vortex 하여 잘 섞어 준 다음, square petridish(10×10×1.5cm)에 분주하였다. underlayagar는 10mM sodium phosphate buffer(pH 7.4)와 1%(w/v) lowelectroendosmosis-type agarose(Sigma), 0.03% MYPGP 배양배지를 이용해 만들었다. 분주한 underlay agar 가 굳으면 직경 10mm의 구명을 뚫어 시료 10μl를 넣고 3시간 동안 시료가 확산되도록 배양한다. 마지막으로 6% TSB와 1%(w/v) agarose가 포함되어 있는 overlay gel을 추가로 분주하여 배지가 굳으면, 37°C에서 24시간 정치 배양하여 생장억제구역(IDZ; inhibition zone distance)을 관찰하였다.
통계처리
모든 실험 결과는 3회 반복 수행된 평균값이며, 각 실험결과에 대한 통계분석은 SPSS program(Ver. 18.0, Chicago, IL, USA)을 이용하였으며, 각 실험군 간의 유의적 차이는 일원배치분산분석(one-way ANOVA)후 Duncan’s multiful range test(p<0.05)로 검증하였다.
결과 및 고찰
동충하초 폐배지 추출물에 의한 용매 분획
본 연구에서는 동충하초 폐배지 추출물(3.5kg)을 MeOH 추출하여 추출물 178.5g을 얻었으며, 이를 대상으로 용매분획을 행하여 n-hexane 층(49.3g), chloroform 층(15.55g) ethyl acetate 층(1.4g), 수포화 BuOH 층(7.77g) 및 H2O 층(36.69g)을 각각 얻었다. 용매분획 후 얻어진 각 획분들은 TLC 분석을 통해(Fig. 2, 3) 각 획분에 함유되어 있는 화합물들의 존재경향을 비교·분석하였다. 이때 동충하초 자실체 추출물을 대조군으로 사용하였다. 그결과, 동충하초 자실체 추출물에서 확인된 spot 들이 동충하초 폐배지 추출물에서 확인된 spot 들과 매우 유사한 경향을 보여, 동충하초 자실체 추출물 및 동충하초 폐배지 추출물에는 서로 유사한 종류의 화합물을 함유하고 있을 것으로 확인된다. 또한 이들의 패턴은 n-hexane 층과도 매우 유사해 동충하초 폐배지 추출물에 함유되어있는 화합물이 n-hexane 층으로 많이 이행되었을 것으로 확인되었다. 그 결과는 cerium sulfate hydrate 발색(Fig. 2-C, 3-C)을 통해 추가로 확인했으며, 그 결과 동충하초 및 동충하초 폐배지 추출물에서 확인된 spot 들이 n-hexane 층과 매우 유사한 패턴으로 존재하는 것이 관찰되었다. spot의 색깔은 흑색과 황색 등 다양한 색이 혼재하고 있어 당류 및 아미노산을 비롯해 페놀성 화합물까지 다양하게 함유되어져 있을 것으로 확인되었다. 또한 DPPH ethanol 용액을 분무하여 항산화 활성화합물들의 존재 경향을 검토한 결과, 비극성 조건인 CHCl3/EtOAc/AcOH/MeOH=9:1:0.1:0.1 (v/v/v/v) 전개 용매에 의해 전개된 화합물의 경우 n-hexane (1)층 및 동충하초 폐배지 추출물 (5)에서만 탈색된 spot이 관찰되는 반면 (Fig. 2-D), 극성조건인 BuOH/AcOH/H2O=4:1:1 (v/v/v) 전개용매에 의해 전개된 화합물의 경우 대부분의 분획물에서 탈색된 spot이 고루 관찰되었다(Fig. 3-D). 이 결과를 통해 동충하초 폐배지 추출물 내 함유되어 있는 항산화 활성을 지닌 비극성 물질은 n-hexane 층으로 대부분 이행 되었으며, 항산화 활성을 지니는 극성 물질은 n-hexane 층을 비롯한 다른 층으로도 상당 부분 이행 된 것으로 확인 할 수 있었다.
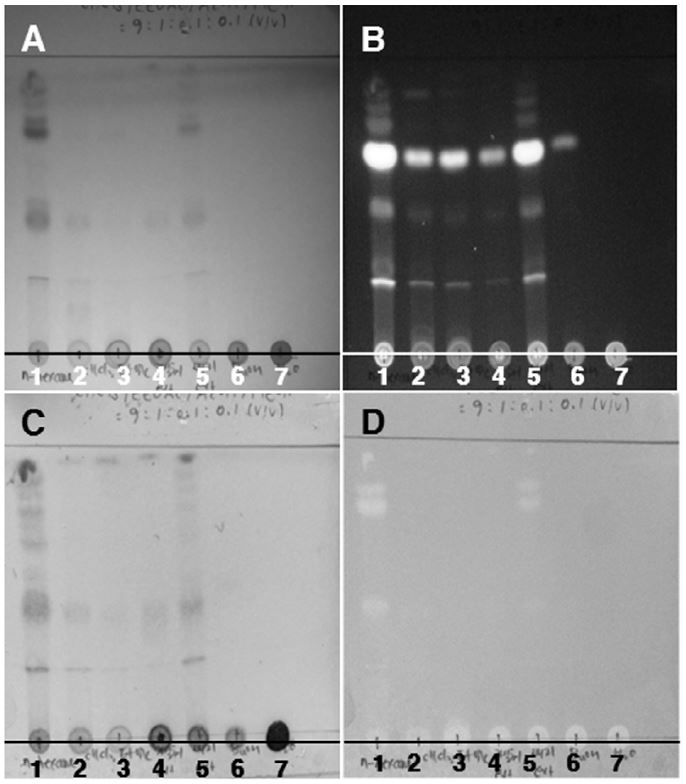
Thin-layer chromatography (TLC) of C. militaris waste product solvent fraction. The TLC plate developed using a mixture CHCl3/EtOAc/AcOH/MeOH=9:1:0.1:0.1 (v/v/v/v) and visualized by UV, DPPH ethanol solution and 1% cerium (IV) sulfate ethanol solution spray.; A, 254nm UV; B, 365nm UV; C, cerium sulfate hydrate.; D, 200μM DPPH ethanol solution. ; 1. n-hexane layer, 2. chloroform layer, 3. ethyl acetate layer, 4. fruit body of C. militaris extract, 5. waste product of C. militaris extract, 6. water-saturated n-butanol, 7. water layer.
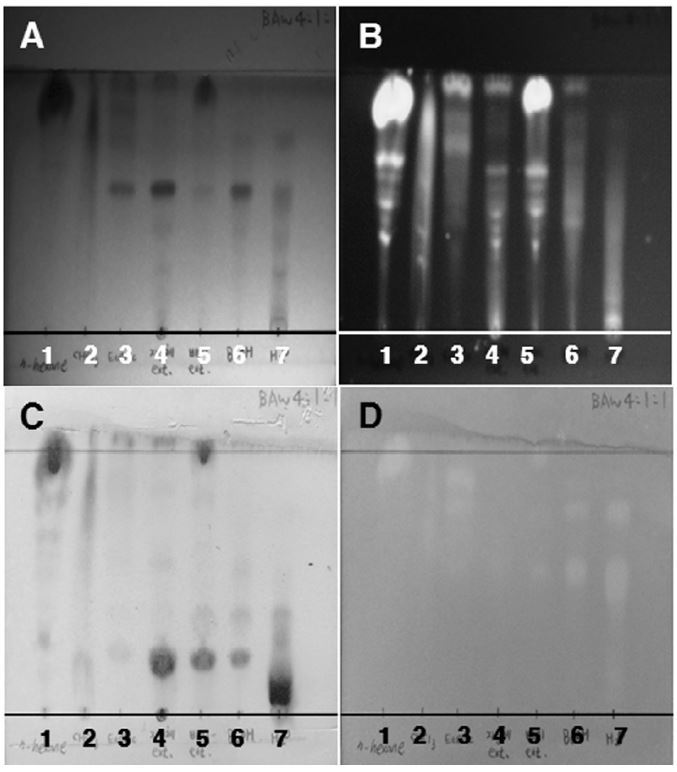
Thin-layer chromatography of C. militaris waste product solvent fraction. The TLC plate developed using a mixture BuOH/AcOH/H2O=4:1:1 (v/v/v) and visualized by UV, DPPH ethanol solution and 1% cerium (IV) sulfate ethanol solution spray.; A, 254nm UV; B, 365nm UV; C, cerium sulfate hydrate.; D, 200μMDPPH ethanol solution. ; 1. n-hexane layer, 2. chloroform layer, 3. ethyl acetate layer, 4. fruit body of C. militaris extract, 5. waste product of C. militaris extract, 6. water-saturated n-butanol, 7. water layer.
Radial diffusion assay에 의한 항균활성 검증
본 연구에서는 radial diffusion assay를 통해 Paenibacillus larvae에 대한 동충하초 폐배지 추출물 및 동충하초 폐배지 용매 분획별 항균활성 효과를 검증하였다(Table 1, Fig. 3). 이때 대조군으로는 현미 동충하초 자실체 추출물을 사용하였으며, 사용된 용매분획물은 현미 동충하초 폐배지 추출물 n-hexane 층 및 chloroform 층, ethyl acetate 층, 수포화 BuOH 층을 사용하였다. 동충하초 폐배지 추출물 및 각각의 분획물은 0mg/ml, 1mg/ml과 10mg/ml에 대한 생장억제구역(IDZ)의 크기를 조사 하였으며, 항균활성 정도는 생장억제구역 크기를 통해 나타내었다(Table 1). 실험에 의한 생장억제구역의 크기는 각각의 분획물 농도에 비례하여 증가하였다. 즉 분획물 0mg/ml 및 1mg/ml에비해 10mg/ml에 대한 생장억제구역 크기가 증가하는 것을 확인할 수 있었다. 분획물의 종류에 따라서는 ethyl acetate 분획물 10mg/ml에서 가장 높은 항균 활성능력이 확인 되었다. 특히 ethyl acetate 획분은 1mg/ml의 농도에서는 MeOH 추출물과 비슷한 5~10mm의 항균 활성을 보이지만, 10mg/ml의 농도 상에서는 15~20mm로 10~15mm의 항균 활성을 보이는 MeOH추출물과는 달리 높은 항균활성을 나타내는 것으로 확인 되었다. 또한 1mg/ml의 농도에서 전혀 항균활성을 나타내지 않았던 수포화 BuOH 획분은 10mg/ml의 농도에서 15~20mm의 높은 항균 활성을 나타내었다(Table 1, Fig. 3). 이 결과는 Reis 등(2013)에 의한 그람 음성균 및 양성균에 대한 항균활성 실험결과와 유사하다. 이들 연구결과에서는 그람 음성균 및 양성균에 대해 밀리타리스 동충하초가 높은 항균활성 효과가 있다고 밝혔는데, 특히 밀리타리스 동충하초 MeOH 추출물의 ethyl acetate 획분과 수포화 BuOH 획분에서만 특이적으로 항균활성을 보인다고 밝혔다.

Antimicrobial activities of C. militaris fruit body and C. militaris waste product solvent fraction against Paenibacillus larvae
지금까지 미국부저병 방제를 위한 천연항생물질의 개발은 주로 프로폴리스 및 다양한 식물의 에센스 오일을 이용한 항균활성 검증에 대한 보고가 이루어 졌다. 그 중 Antúnez(2008) 등은 1% 프로폴리스 에탄올 추출물에서 P. larvae 에 대해 20~30mm 정도의 항균활성을 보였으며, 이는 프로폴리스 내에 함유하고 있는 페놀 및 플라보노이드 성분에 의한 항균 작용일 것으로 여겨진다. Fuselli 등은(2008) 감귤류로부터 추출한 에센스 오일로부터 P. larvae에 대한 항균활성 효과를 검증한 바 있다. 이들에 따르면, 감귤 에센스의 P. larvae에 대한 항균활성은 감귤류가 함유하고 있는 테르펜의 수산화기로부터 기인하는 것이라고 밝혔다. Bilikova 등(2013)은 프로폴리스 ethyl acetate 층으로부터 극성의 신규화합물을 분리하여 부저병 균주에 대한 우수한 항균활성 효과를 확인 하였는데, 이 또한 페놀성 물질이 가지는 수산화기가 P. larvae에 대한 항균활성에 영향을 미치는 것으로 판단되었다. 이러한 결과 등을 종합하면 미국부저병 원인균인 P. larvae는 페놀성 물질 등이 함유하고 있는 수산화기에 의해 항균활성 효과를 보이는 것으로 확인된다. 본 연구결과에서는 동충하초 자실체 및 동충하초 폐배지 추출물의 P. larvae에 대한 항균활성 효과를 검증하였다. 특히 ethyl acetate 층에서 가장 강한 항균활성 효과가 있는 것으로 확인되었는데, 이는 동충하초 자실체 및 동충하초 폐배지 추출물이 함유하고 있는 물질 중 수산화 기를 함유하고 있는 극성 물질이 ethyl acetate 층으로 다량 전이 되어 나타난 결과로 여겨진다. 이는 추후 후속연구 등을 통해 단일 물질을 분리하고 기작을 밝힐 필요가 있을 것으로 사료된다.
본 연구에서는 동충하초 폐배지 추출물의 분획물로 부터 부저병 원인 균주인 P. larvae에 대한 항균활성을 검증 하였다. 이는 동충하초 및 동충하초 폐배지 추출물로부터 부저병 억제효과를 확인한 첫 번째 사례이다. 동충하초 폐배지는 동충하초를 접종하여 키운 배양배지로, 자원으로 활용이 되지는 않지만 cordycepin 등의 동충하초 생리활성 유효성분이 전이되어 동충하초 자실체와 유사한 생리활성 기능을 가지고 있는 것으로 확인된다. 그러나 동충하초 폐배지는 자실체에 비해 1/10 이상 낮은 가격으로 구매가 가능하여 저렴한 비용으로 양봉농가에서 천연물 약제로 활용이 가능할 것으로 여겨진다. 특히 저자는 앞선연구에서 동충하초 폐배지 추출물이 꿀벌 질병중 하나인 노제마 질병 방제에 효과가 있는 것을 확인하였다(김 등, 2015). 이는 동충하초 폐배지 추출물을 이용하여 꿀벌의 주요 질병인 미국부저병을 비롯하여 꿀벌 노제마병까지 동시 방제할 수 있는 가능성을 제시함으로써, 방제비용 및 노동력 절감 효과가 클 것으로 기대된다. 본 연구에서는 또한 동충하초 폐배지 추출물 용매 분획별 항균효과를 별도로 검증하였다. 이로써 동충하초 및 폐배지가 함유하고 있는 유효물질을 분리하는데 기초자료로 활용이 가능할 것으로 생각된다.
적 요
미국부저병(American foulbrood, AFB)은 Paenibacillus larvae에 의해 발생되는 세균성 질병으로, 내생 포자 생성으로 인해 방제가 어려워 꿀벌에 심각한 피해를 끼치는 꿀벌의 주요 질병 중 하나이다. 미국부저병의 방제는 주로 항생제에 의존하고 있으나, 현재 유럽의 대부분의 국가에서는 미국부저병 방제에 항생제 사용을 엄격히 금지하고 있는데다 최근 양봉산물 내항생물질의 잔류 및 내성균의 출현 등의 문제로 인해 이를 대체할 수 있는 천연방제제의 개발이 시급한 상황이다. 본 연구에서는 동충하초 배지 추출물을 이용한 꿀벌 부저병 천연물 방제를 위해 동충하초 배지 추출물을 용매 분획하여 TLC 크로마토그래피를 수행하였다. 먼저 3.5kg의 동충하초 배지 분말을 메탄올로 추출하여(178.5g) 이를 대상으로 용매분획을 행하여 n-hexane 층(49.3g), chloroform 층(15.55g) ethyl acetate 층(1.4g), 수포화 BuOH 층(7.77g) 및 H2O 층(36.69g)을 각각 얻었다. 용매분획 후 얻어진 각 획분들은 TLC 분석을 실시하였으며, 이들 획분에 대한 P. larvae 항균활성을 검증하기 위한 radial diffusion assay를 수행하였다. 그 결과 수포화 BuOH 및 ethyl acetate 획분 10mg/ml의 농도에서의 생장억제구역(IDZ)의 크기는 15~20mm로 가장 높은 항균 활성 능력이 있는 것으로 확인되었다. 이는 동충하초 및 동충하초 폐배지 추출물로부터 부저병 억제효과를 확인한 첫 번째 사례이며 추후 동충하초 폐배지 추출물에 대한 유효물질 분리를 위한 기초자료로 제공될 수 있을 것으로 기대된다.
Acknowledgments
본 연구는 농촌진흥청 시험연구사업(PJ01120101)의 연구비로 수행된 결과이며 이에 깊은 감사를 드립니다.
인 용 문 헌
- 김혜경, 홍인표, 트란, 반 또안, 이명렬, 최용수, 심하식, 변규호, 강아랑, (2015), 동충하초 배지 추출물을 이용한 꿀벌 노제마병 방제, Journal of Apiculture, 30(2), p119-126.
- 김혜주, 이태호, 권용삼, 손미원, 김채균, (2012), 밀리타리스 동충하초(Cordyceps militaris) 에탄올 추출물의 면역억제 마우스 면역활성에 미치는 영향, 한국식품영양과학회지, 41(4), p494-500.
- 조월순, 남병혁, 오수정, 최유진, 강은영, 홍숙희, 이상호, 정민호, (2008), 굼벵이 유래 밀리타리스 동충하초 열수추출물의 간기능개선 효과 및 단화독성 평가, 한국식품과학회지, 40(1), p106-110.
- 최재훈, 김금숙, 이승은, 조재한, 성기호, 이대영, 김승유, 이태호, 노형준, (2012), 밀리타리스 동충하초 추출물의 항염활성 효과, 한국버섯학회지, 10(4), p249-253.
-
Ahn, Y.J., S.J. Park, S.G. Lee, S.C. Shin, and D.H. Choi, (2000), Cordycepin: Selective Growth Inhibitor Derived from Liquid Culture of Cordyceps militaris against Clostridium spp, Journal of agricultural and food chemistry, 48(7), p2744-2748.
[https://doi.org/10.1021/jf990862n]

-
Antúnez, K., Harriet, J., Gende, L., Maggi, M., Eguaras, M., and P. Zunino, (2008), Efficacy of natural propolis extract in the control of American Foulbrood, Veterinary Microbiology, 131(3), p324-331.
[https://doi.org/10.1016/j.vetmic.2008.04.011]

-
Bailey, L., (1975), Recent research on honey bee viruses, Bee World, 56, p55-64.
[https://doi.org/10.1080/0005772X.1975.11097544]

- Bailey, L., and B.V. Ball, (1991), Honey Bee Pathology, second ed., Academic Press, London, UK.
-
Bakonyi, T., R. Farkas, A. Szendroi, M. Dobos-Kovacs, and M. Rusvai, (2002), Detection of acute bee paralysis virus by RT-PCR in honey bee and Varroa destructor field samples: rapid screening of representative Hungarian apiaries, Apidologie, 33, p63-74.
[https://doi.org/10.1051/apido:2001004]

-
Bilikova, K., Popova, M., Trusheva, B., and V. Bankova, (2013), New anti-Paenibacillus larvae substances purified from propolis, Apidologie, 44(3), p278-285.
[https://doi.org/10.1007/s13592-012-0178-1]

-
Das, S. K., Masuda, M., Sakurai, A., and M. Sakakibara, (2010), Medicinal uses of the mushroom Cordyceps militaris: current state and prospects, Fitoterapia, 81(8), p961-968.
[https://doi.org/10.1016/j.fitote.2010.07.010]

-
Evans, J. D., and T.N. Armstrong, (2006), Antagonistic interactions between honey bee bacterial symbionts and implications for disease, BMC Ecology, 6, p4.
[https://doi.org/10.1186/1472-6785-6-4]

-
Fuselli, S. R., de la Rosa, S. B. G., Eguaras, M. J., and Fritz, R., (2008), Chemical composition and antimicrobial activity of Citrus essences on honeybee bacterial pathogen Paenibacillus larvae, the causal agent of American foulbrood, World Journal of Microbiology and Biotechnology, 24(10), p2067-2072.
[https://doi.org/10.1007/s11274-008-9711-9]

-
Genersch, E., Forsgren, E., Pentikáinen, J., Ashiralieva, A., Rauch, S., Kilwinski, J., and Fries, I., (2006), Reclassification of Paenibacillus larvae subsp. pulvifaciens and Paenibacillus larvae subsp. larvae as Paenibacillus larvae without subspecies differentiation, International Journal of Systematic and Evolutionary Microbiology, 56(3), p501-511.
[https://doi.org/10.1099/ijs.0.63928-0]

-
Gu, Y. X., Want, Z. S., Li, S. X., and Q. S. Yuan, (2007), Effects of multiple factors on accumulation of nucleosides and bases in Corydyceps militaris, Food Chemistry, 102, p1304-1309.
[https://doi.org/10.1016/j.foodchem.2006.07.018]

-
Han, J.Y., J. Im, J.N. Choi, C.H. Lee, H.J. Park, D.K. Park, C.H. Yun, and S.H. Han, (2010), Induction of IL-8 expression by Cordyceps militaris grown on germinated soybeans through lipid rafts formation and signaling pathways via ERK and JNK in A549 cells, Journal of Ethnopharmacology, 127, p55-61.
[https://doi.org/10.1016/j.jep.2009.09.051]

- Ho, M.W., and J. Cummins, (2007), Mystery of disappearing honeybees, Science in Society, 34, p35-36.
-
Kim, C.S., S.Y. Lee, S.H. Cho, Y.M. Ko, B.H. Kim, H.J. Kim, J.C. Park, D.K. Kim, H. Ahn, B.O. Kim, S.H. Lim, H.S. Chun, and D.K. Kim, (2008), Cordyceps militaris induces the IL-18 expression via its promoter activation for IFN-gamma production, Journal of Ethnopharmacology, 120(3), p366-371.
[https://doi.org/10.1016/j.jep.2008.09.010]

-
Kochansky, J., Knox, D., Feldlaufer, M., and J. Pettis, (2001), Screening alternative antibiotics against oxytetracycline-susceptible and-resistant Paenibacillus larvae, Apidologie, 32(3), p215-222.
[https://doi.org/10.1051/apido:2001123]

-
Lehrer, R. I., Rosenman, M., Harwig, S. S., Jackson, R., and P. Eisenhauer, (1991), Ultrasensitive assays for endogenous antimicrobial polypeptides, Journal of immunological methods, 137(2), p167-173.
[https://doi.org/10.1016/0022-1759(91)90021-7]

- Matheson, A., and Reid, M., (1992), Strategies for the prevention and control of American foulbrood. II, American bee journal, 132, p399-402.
-
Park, C., S.H. Hong, J.Y. Lee, G.Y. Kim, B.T. Choi, Y.T. Lee, D.I. Park, Y.M. Park, and Y.H. Choi, (2005), Growth inhibition of U937 leukemia cells by aqueous extract of Cordyceps militaris through induction of apoptosis, Oncology Reports, 13(6), p1211-1216.
[https://doi.org/10.3892/or.13.6.1211]

-
Piccini, C., and P. Zunino, (2001), American foulbrood in Uruguay: isolation of Paenibacillus larvae larvae from larvae with clinical symptoms and adult honeybees and susceptibility to oxytretracycline, Journal of Invertebrate Pathology, 78, p176-177.
[https://doi.org/10.1006/jipa.2001.5055]

-
Reis, F. S., Barros, L., Calhelha, R., Ciric, A., Van Griensven, L. J., Sokovic, M., and I. C. Ferreira, (2013), The methanolic extract of Cordyceps militaris (L.) Link fruiting body shows antioxidant, antibacterial, antifungal and antihuman tumor cell lines properties, Food and chemical toxicology, 62, p91-98.
[https://doi.org/10.1016/j.fct.2013.08.033]

-
Watanabe, M. E., (2008), Colony collapse disorder: Many suspects, no smoking gun, BioScience, 58, p384-388.
[https://doi.org/10.1641/B580503]

-
Wedenig, M., Riessberger-Galle, U., and K. Crailsheim, (2003), A substance in honey bee larvae inhibits the growth of Paenibacillus larvae larvae, Apidologie, 34, p43-51.
[https://doi.org/10.1051/apido:2002043]

- White, G. F., (1906), The bacteria of the apiary with special reference to bee disease, USDA, Bureau of Entomology, Technical Series, 14, p1-50.