국내산 프로폴리스로부터 Pinocembrin 성분 분석
Abstract
Propolis is a resinous substance collected by honeybees to seal honeycomb, which has been used with broad clinical applications. The chemical characteristics of propolis are linked to the diversity of geographical location, plant sources and bee species. The aim of this study was to characterize Korean propolis components and quantifying their component content by ultra-performance liquid chromatography (UPLC). Methanol extracts of propolis were comprehensively analysed by UPLC for the isolation and quantification of pinocembrin in propolis of different geographic. All of the propolis samples, except that from Jeju island, contained pinocembrin. Concentration of pinocembrin ranged between the 11.0~38.1mg/g. Concentration of pinocembrin showed some variation among the propolis samples from different origins. The pinocembrin of the analysed propolis samples confirm its affiliation to the Korean propolis.
Keywords:
Korea, Propolis, Pinocembrin, UPLC, NMR서 론
프로폴리스는 꿀벌(Apis mellifera L.)의 일벌이 식물의 진액을 수집하여 타액 등으로 가공한 후 대시로 씹은 끈적끈적한 물질의 양봉산물이다(Fearnley, 2001). 프로폴리스의 성분은 수집원이 되는 식물의 종류나 계절에 따라 차이가 있으며, 주로 flavonoids, phenolic acids 등의 유기화합물로 구성되어있다(Markham et al., 1996; Fearnley 2001; Kuropatnicki et al., 2013). 꿀벌은 프로폴리스를 벌통 내부에 발라 세균과 바이러스 등의 병균을 막는 성벽과 같은 역할을 한다(Fearnley 2001). 역사적으로 오래 전부터 프로폴리스의 다양한 생리활성효과로 인해 의료용 소재로 활용되어 왔으며, 우리나라에서는 치주질환 및 항산화 기능을 갖는 기능성식품원료로 사용되고 있다(Korea Food & Drug Administration 2010). 프로폴리스의 항균작용에 대한 연구는 1948년 브라질산 프로폴리스에서 Straphylococcus aureus에 대한 항균효과가 밝혀짐에 따라 브라질산 프로폴리스에 대한 다양한 세균 및 진균에 대한 항균효과가 규명되었다(Guzman 2014; Silva-Carvalho et al., 2015). 그러나 프로폴리스는 성분은 지역에 따른 식물분포, 기후에 따라 다양한 성분의 차이를 갖고 있으며, 성분의 차이에 따라 프로폴리스의 생리활성도 다르게 나타나는 것으로 알려져 있다(Bankova et al., 2000; Banskota et al., 2001; Huang et al., 2014). 이러한 성분의 차이로 인해 많은 나라에서는 프로폴리스 성분의 표준화 및 차별화를 위하여 자국 내에서 생산되는 프로폴리스의 성분을 구명하고 데이터베이스 구축을 위한 연구가 활발히 이루어지 있다. 우리나라에서도 프로폴리스의 생리활성 뿐만 아니라 성분에 대한 연구가 오래전부터 이루어지고 있으며, 제주도 지역의 식생과 기후가 다른 지역과 달라 프로폴리스의 성분에 있어서도 많은 차이를 갖고 있다고 알려져 있다(Jeong et al., 2003, 2010). 그러나 국내에서 채취되고 있는 프로폴리스에 대한 성분의 데이터베이스 구축 및 분석법에 대한 연구는 물론 외국산 프로폴리스와의 차별화에 대한 연구가 미흡한 실정이다. 따라서 본 연구에서는 국내에서 채취한 프로폴리스로부터 단일 성분을 분리하고, 분리한 성분의 구조 동정을 통해 데이터베이스를 구축하여 국내산 프로폴리스의 다양한 식의약소재 개발과 외국산 프로폴리스와의 차별화를 위한 기초자료 이용하고자 하였으며, 이들 성분을 분석하기 위한 분석법을 개발하고자 하였다.
재료 및 방법
공시 시료
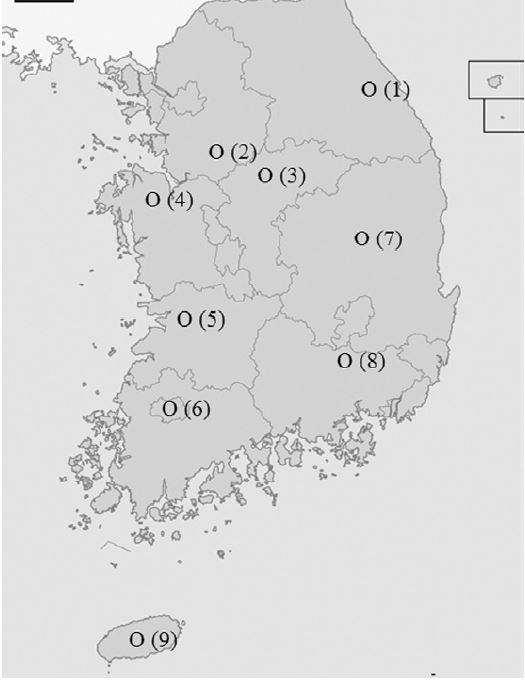
연구에 사용한 시료는 국내 양봉농가에서 2014년도에 채집된 프로폴리스 원괴를 직접 구입하여 실험에 사용하였다(Table 1, Fig. 1). 각 지역의 양봉농가 임의로 한 곳을 지정하여 1kg의 시료를 수집하였다.
시약 및 기기
프로폴리스의 구성성분 추출 및 성분분리에 사용한 methanol, hexane, methylene chloride, ethyl acetate 및 butanol은 SK chemical(Seongnam, Korea)사, HPLC 등급의 분석용매 acetonitrile은 Burdik & Jackson(MI, USA)사, TLC plate(layer thickness 0.25mm, 20×20cm, Art. No. 5715) 및 silica gel(40~63μm, Art. No. 9385)은 Merck(Darmstadt, Germany)사, MCI gel은 Mitsubishi chemical(CHP20/P120, Tokyo, Japan)사에서 구입하였다. NMR spectrometer는 JEOL(Tokyo, Japan)사의 JNMECA600(600 MHz)을 사용하였으며, NMR용 DMSO-d6는 Cambridge Isotope Laboratories(MA, USA)사에서 구입하였다.
추출 및 분리
프로폴리스 원괴 70g을 methanol로 60분간 3회 초음파 추출하였다. 추출액은 여과한 후 감압하에 농축하여 methanol 추출물 38.7g을 얻었다. 얻어진 methanol 추출물을 10배수의 3차 증류수에 현탁시키고 계통분획법에 의하여 hexane, ethyl acetate, 수포화 butanol 순으로 분획하였으며, 각각의 분획물을 농축한 후 수득한 무게는 5.5g, 32g, 0.7g이었다. Ethyl acetate 분획물 30g에 대하여 MCI gel 컬럼 크로마토그래피를 실시하고 methanol(20%→100%)로 용출시킨 후, TLC로 분석하여 유사한 Rf(retention factor)치를 나타내는 9개의 소분획으로 나누었다(GPEF 1-9). 이들 분획 중 주요성분이 함유된 GPEF 5(12g)에 대하여 silica gel을 충진시킨 컬럼에 methylene chloride:methanol(99:1→50:50)을 이동상으로 사용하여 8개의 소분획(GPEF 51-58)으로 나누었으며, 이들 소분획 중 결정이 석출된 GPEF 56을 여과한 후, methanol로 재결정하여 침상결정을 가진 화합물 1(325mg)을 분리하였다.
정량분석
분리한 성분의 정량 분석을 위한 최적 방법을 구축을 위하여 9개 지역으로부터 수집한 프로폴리스 원괴를 80% ethanol을 사용하여 5mg/mL이 되도록 만든 후, 초음파 추출기에서 45분간 추출하여 전 처리하였다. 추출액은 0.2μm PTFE 필터로 여과하여 분석에 사용하였다. 정량분석에 사용된 기기는Waters(MA, USA)사의 PDA(photo diode array)검출기가 장착된 Acquity UPLC I-Class를 사용하였다. Waters사의 BEH C18(50×2.1mm, 1.7um)컬럼을 사용하여 Table 2와 같은 조건으로 정량 분석하였다.
결과 및 고찰
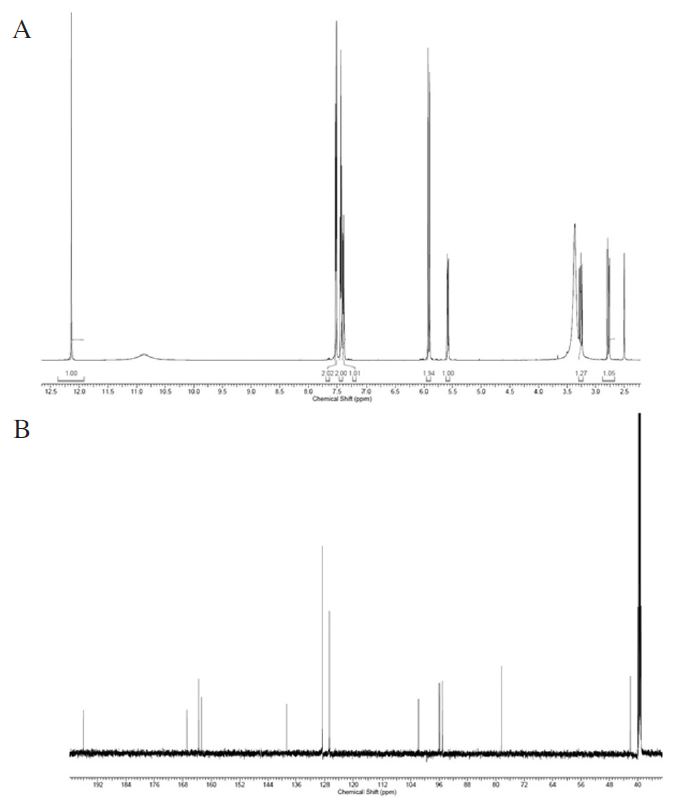
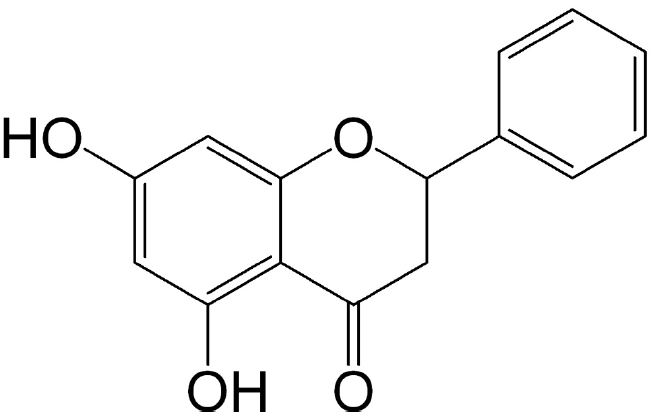
화합물 1은 무색의 침상결정으로 1H-NMR(600 Hz, DMSO-d6) spectrum으로부터 δ12.8(1H, s)에서 hydroxyl로 추정되는 피크가 관찰되었다(Fig. 2A, Table 3). 전형적인 aromatic protons가 나타나는 δ7.52-7.41 영역에서 multiplet으로 5개의 olefinic methine proton signal이 관찰되어 benzene ring의 존재가 확인되었다(Fig. 2A, Table 3). 또한 δ5.93과 δ5.90에 관찰된 olefinic methine proton signal은 benzene ring에서 meta-coupling(J=1.8 Hz)을 보이는 것으로 확인되었으며, δ5.58에서 관찰된 oxygenated proton signal과 δ3.26 및 δ2.78에서 관찰된 methylene proton이 서로 vicinal coupling을 하는 것으로 나타나 flavanone 계열 화합물임을 알 수 있었다(Fig. 2A, Table 3). 13C-NMR(150 MHz, DMSO-d6) spectrum으로부터 15개의 carbon signal을 확인하였고, DEPT 90 및 135 spectra를 통하여 δ196.0, 163.5, 166.8, 162.8, 101.8 및 138.7에서 quaternary carbon 6개, δ42.1에서 methylene carbon 1개, δ78.4, 96.0, 95.1, 126.7, 128.6에서 methine carbon 8개가 관찰되었으며, HMBC spectrum을 이용하여 proton과 carbon의 상관관계를 확인하였다(Fig. 2B, Table 3). 상기 결과와 문헌치(Zhou et al., 1999)를 비교하여 화합물은 1 flavanone 계열의 pinocembrin (5,7-dihydroxy-2-phenyl-2,3-dihydrochromen-4-one)으로 동정하였다(Fig. 3).
Pinocembrin은 온대지역에서 채집되는 프로폴리스의 특징을 갖는 B-ring에 hydroxyl과 같은 치환기가 없는 대표적인 flavonoid 성분으로 알려져 있다(Banskota et al., 2001; Huang et al., 2014). Table 4에 각 지역에서 채집된 프로폴리스로부터 pinocembrin을 정량한 결과 11.0에서 38.1mg/g의 범위에서 확인되었으며, 아열대기후를 갖는 제주도에서 채취한 프로폴리스에서는 전혀 검출되지 않았다(Fig. 4, Table 4). 또한 pinocembrin의 함량에서 있어서도 전주와 광주 등 비교적 기온이 높은 지역에서 채취한 프로폴리스에서는 적은 양을 갖고 있었으며, 강릉, 안동 등 사계절이 뚜렷한 지역에서는 함량이 높게 검출되었다. Pinocembrin은 온대지역에서 채취되는 프로폴리스의 특성 중의 하나로, 항진균 및 뇌신경 활성화 효능을 갖는 성분으로 알려져 있다(Metzner et al., 1977; Bankova et al., 2000; Liu et al., 2008).
본 연구결과를 통해 프로폴리스로부터 pinocembrin의 정량 정성분석법을 확립하였으며, pinocembrin의 성분이 풍부한 국내산 프로폴리스를 이용하여 항진균 및 뇌신경 활성화 기능을 갖는 다양한 제품 개발이 가능할 것으로 사료된다.
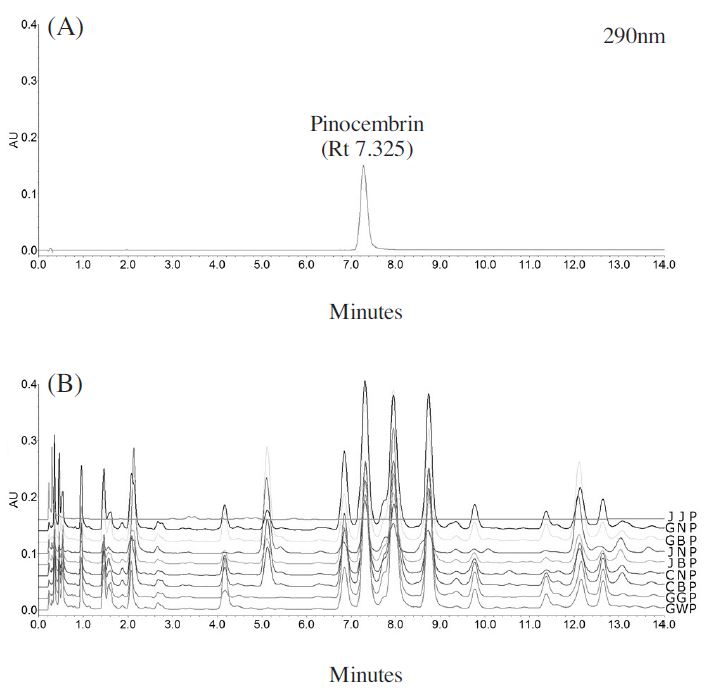
UPLC chromatograms of (A) pinocembrin and (B) propolis samples collected from different locations throughout Korea.
적 요
국내 프로폴리스 성분 특성을 알아보고자 제주도를 포함하여 9개 지역으로부터 프로폴리스를 채집하여 성분 분석을 하였다. 그 결과 제주도를 제외하고 모든 지역에서 pinocembrin 성분이 분리되었으며, 이는 pinocembrin이 사계절이 뚜렷하고 기온이 비교적 낮은 산간지역에서 채취한 프로폴리스의 특성 중 하나로 우리나라에서도 일치하였다. 항진균 및 뇌신경 활성 성분인 pinocembrin을 함유한 프로폴리스의 다양한 식의약품을 개발하는 데 있어 지표 성분으로 뿐만 아니라 외국산과의 차별화에도 활용할 수 있을 것으로 사료된다. 또한 UPLC를 사용하여 프로폴리스로부터 pinocembrin를 정량 정성하는데 방법을 확립하였다.
Acknowledgments
본 연구는 농촌진흥청 어젠다연구사업(과제번호: PJ01091202)에 의하여 수행되었으므로 감사를 드립니다.
인 용 문 헌
-
Bankova, V., S. De Castro, and M. Marcucci, (2000), Propolis: recent advances in chemistry and plant origin, Apidologie, 31, p3-15.
[https://doi.org/10.1051/apido:2000102]

-
Banskota, A. H., Y. Tezuka, and S. Kadota, (2001), Recent progress in pharmacological research of propolis, Phytother Res, 15, p561-571.
[https://doi.org/10.1002/ptr.1029]

- Fearnley, J., (2001), Bee propolis, Souvenir Press, London, UK, p10-132.
-
Guzman, J. D., (2014), Natural cinnamic acids, synthetic derivatives and hybrids with antimicrobial activity, Molecules, 19, p19292-19349.
[https://doi.org/10.3390/molecules191219292]

-
Huang, S., C. P. Zhang, K. Wang, G. Q. Li, and F. L. Hu, (2014), Recent advances in the chemical composition of propolis, Molecules, 19, p19610-19632.
[https://doi.org/10.3390/molecules191219610]

-
Jeong, C.H., Y.I. Bae, H.J. Lee, and K.H. Shim, (2003), Chemical Components of Propolis and Its Ethanolic Extracts, J Korean Soc Food Sci Nutr, 32, p501-505.
[https://doi.org/10.3746/jkfn.2003.32.4.501]

-
Jeong, C.H., C.S. Shin, Y.I. Bae, and K.H. Shim, (2010), Antioxidant Activities of Ethanol and Water Extracts from Propolis, J Korean Soc Food Sci Nutr, 39, p1725-1730.
[https://doi.org/10.3746/jkfn.2010.39.12.1725]

- Korea Food & Drug Administration, (2010), Health Functional Food Code, Osong, Korea, p II.2.2.3.
-
Kusters, J. G., A. H. van Vliet, and E. J. Kuipers, (2006), Pathogenesis of Helicobacter pylori infection, Clin Microbiol Rev, 19, p449-490.
[https://doi.org/10.1128/CMR.00054-05]

-
Liu, R., M. Gao, Z. H. Yang, and G. H. Du, (2008), Pinocembrin protects rat brain against oxidation and apoptosis induced by ischemia-reperfusion both in vivo and in vitro, Brain research, 1216, p104-115.
[https://doi.org/10.1016/j.brainres.2008.03.049]

-
Markham, K. E., K. A. Mitchel, A. L. Wilkin, J. A. Daldy, and Y. Lu, (1996), HPLC and GC-MS identification of the major organic constituents in New Zealand propolis, Phytochemistry, 42, p205-211.
[https://doi.org/10.1016/0031-9422(96)83286-9]

- Metzner, J., E. M. Schneidewind, and E. Friedrich, (1977), Effect of propolis and pinocembrin on fungi, Die Pharmazie, 32, p730.
-
Silva-Carvalho, R., F. Baltazar, and C. Almeida-Aguiar, (2015), Propolis: A Complex Natural Product with a Plethora of Biological Activities That Can Be Explored for Drug Development, Evid Based Complement Alternat Med.
[https://doi.org/10.1155/2015/206439]

- Zhou, L., J. Guo, and J. Yu, (1999), Flavonoids from Beijing propolis, Zhongguo Zhong Yao Za Zhi., 24, p162-164.